Klinische Anwendung
Ü04
Inspirationen aus der Natur für innovative Materialien
*M. Thielen1,2, T. Speck1,2,3,4
1Botanischer Garten der Universität Freiburg, Plant Biomechanics Group, Freiburg, Deutschland
2 Freiburger Materialforschungszentrum (FMF), Freiburg, Deutschland
3 Kompetenznetz Biomimetik, Freiburg, Deutschland
4 Freiburger Zentrum für interaktive Werkstoffe und bioinspirierte Technologien (FIT), Freiburg, Deutschland
Bionik ist eine hochgradig interdisziplinäre Wissenschaftsdisziplin. Ihr Ziel ist es, Strukturen und Funktionen aus der Biologie, die im Verlauf von 3,8 Milliarden Evolution entstanden sind, in neuartige technische Anwendungen zu übertragen. Die Entwicklung biologisch inspirierter technischer Materialien oder Produkte, läuft ausgehend vom biologischen Vorbild in der Regel über mehrere Abstraktions- und Modifikationsschritte. Nicht nur durch die verstärkte Suche nach innovativen und nachhaltigen Technikkonzepten hat die Bionik in den letzten Jahren einen starken Aufschwung genommen. Genauso wichtig waren die Entwicklung neuer Analyse-, Modellierungs- und Fertigungsverfahren. Sie erlauben es, den Form-Struktur-Funktions-Zusammenhang der biologischen Vorbilder und der bionischen Produkte bis auf die molekulare Ebene quantitativ zu analysieren und technische Produkte hierarchisch strukturiert, d.h. aufbauend vom Kleinen zum Großen, in marktfähiger Menge herzustellen. Anhand von ausgewählten Beispielen aus der Plant Biomechanics Group Freiburg werden aktuelle Entwicklungen im Bereich bionische Materialien, Strukturen und Oberflächen vorgestellt, die auch für verschiedene Anwendungen im Bereich der Medizin Anwendung finden könnten. Die Beispiele beinhalten energiedissipierende Materialien und Strukturen, selbstreparierende Materialien, adaptive Haft- und Antihaftstrukturen, ultraleichte Faserverbundstrukturen sowie adaptive elastische Strukturen wie sie beispielsweise bei bionischen Fassadenverschattungen zum Einsatz kommen.
Referenzen:
J. Knippers & T. Speck (2012): Design and construction principles in Nature and Architecture. – Bioinspiration and Biomimetics, 7. DOI:10.1088/1748-3182/7/1/015002
T. Masselter, W. Barthlott, G. Bauer, J. Bertling, F. Cichy, P. Ditsche-Kuru, F. Gallenmüller, M. Gude, T. Haushahn, M. Hermann, H. Immink,
J. Knippers, J. Lienhard, R. Luchsinger, K. Lunz, C. Mattheck, M. Milwich, N. Mölders, C. Neinhuis, A. Nellesen, S. Poppinga, M. Rechberger,
S. Schleicher, C. Schmitt, H. Schwager, R. Seidel, O. Speck, T. Stegmaier, I. Tesari, M. Thielen & T. Speck (2012): Biomimetic products. – In:
Y. Bar-Cohen (ed.), Biomimetics: nature-based innovation, 377-429. CRC Press / Taylor & Francis Group, Boca Raton, London, New York.
B. Prüm, R. Seidel, H.F. Bohn, S. Rubach & T. Speck (2013): Microscopical surface roughness: a relevant factor for slipperiness of plant surfaces with cuticular folds and their replica. – Acta Biomaterialia, 9: 6360 – 6368.
T. Speck, R. Mülhaupt & O. Speck (2013): Self-healing in plants as bio-inspiration for self-repairing polymers. – In: W. Binder (ed.), Self-Healing Polymers, 61 - 89. Wiley-VCH, Weinheim.
M. Thielen, T. Speck & R. Seidel (2015): Impact behaviour of freeze-dried and fresh pomelo (Citrus maxima) peel – Influence of the hydration state. – Royal Society Open Science, 2:140322. DOI.org/10.1098/rsos.140322.
V65
The synergy of autologous biomaterials and artificially designed scaffolds in dentoalveolar surgery: a concept for bone tissue engineering in implantation procedures.
*D. Bulgin1
1Polyclinic “ME-DENT” the Center for Regenerative Medicine , Molecular Medicine and Cell Technologies, Rovinj, Kroatien
Introduction:
Interest in applications for bone tissue engineering in dentistry continues to increas as clinically relevant methods alternative to traditional treatments. Recent progress in the studies of molecular basis of bone development and regeneration, adult stem cell biology, will provide fundamental knowledge for that. This information is already being used for the generation of dentoalveolar tissues in vitro and in vivo [1,2]. Autologous biomaterials enriched with progenitor/stem cells and growth factors can be produced from components of bone marrow, peripheral blood, adipose tissue, cancellous bone, and represent a very interesting research field for dental bone regeneration and suppose a good perspective of future in the clinical dentistry [3]. The adjunctive clinical benefit of the autologous biomaterials preparation can be explained on the basis of tissue engineering, i.e., tissue engineering generally combines three key elements for regeneration: 1) scaffolds or matrices, 2) signaling molecules or growth factors, and 3) cells. Stem cells need a scaffolds that facility their integration, differentiation, matrix synthesis and promote multiple specific interactions between cells. Synthetic or artificially designed substitutes has numerous interconnecting pathways similar to cancellous bone and facilitates bone formation by providing an exceptional osteoconductive scaffolding which results from the retention of the natural porous architecture and trabeculation of human cancellous bone. Synthetic scaffolds show resorbable characters during bone regeneration, and can be completely substituted for the bone tissue after stimulation of bone formation [4].
Materials and Methods:
Our experience with autologous biomaterials combined with artificially designed scaffolds in the treatment of various dental bone defects is presented. The techniques are based on stimulation of natural events continuously present in living bone, that is, the process of bone remodeling and offering both osteoinduction and osteoconductive features.
Discussion:
The use of autologous biomaterials combined with synthetic scaffolds is a recent and promising innovation in dental bone regeneration [5]. Dental bone tissue engineering could not have advanced to the current stage without the incorporation of interdisciplinary skill sets of stem cell biology, bioengineering, polymer chemistry, mechanical engineering, robotics, etc.
References:
1. Prescott RS, Alsanea R, Fayad MI, et al. (2008) In vivo generation of dental pulp-like tissue by using dental pulp stem cells, a collagen scaffold, and dentin matrix protein 1 after subcutaneous transplantation in mice. J Endod 34: 421-426.
2. Huang GT, Gronthos S, Shi S (2009) Mesenchymal stem cells derived from dental tissues vs. those from other sources: their biology and role in regenerative medicine. J Dent Res 88: 792-806.
3. Bulgin D, Hodzic E, Komljenovic-Blitva D (2011) Advanced and prospective technologies for potential use in craniofacial tissues regeneration by stem cells and growth factors. J Craniofac Surg 22: 342-348.
4. Kamitahara M, Ohtsuki C, Miyazaki T (2008) Review paper: behavior of ceramic biomaterials derived from tricalcium phosphate in physiological condition. J Biomater Appl 23: 197-212.
5. Uchida M, Agata H, Sagara H, Shinohara Y, Kagami H, et al. (2009) Mixing conditions for cell scaffolds affect the bone formation induced by bone engineering with human bone marrow stromal cells, beta-tricalcium phosphate granules, and rhBMP-2. J Biomed Mater Res A 91: 84-91.
V66
Biomechanische Evaluation der Schraubenaugmentation mit einem innovativen injizierbaren anwendungsfertigen Calciumphosphatzement am Schenkelhalsfrakturmodell
*L. Konstantinidis1, A. Wörner1, E. Langenmair1, A. Bernstein1, A. Hirschmüller1, P. Helwig1, N. P. Südkamp1
1Universitätsklinik Freiburg, Freiburg, Deutschland
Einleitung:
Die Augmentation von Osteosynthesen mittels Polymethylmetacrylat (PMMA) hat sich vor allem für die Wirbelsäule, das proximale Femur und den Humerus bereits etabliert. Calciumphosphatzement (CPC) stellt eine biologische Alternative zur Augmentation dar; Vorteile sind dabei die geringere Hitzeentwicklung und die gute Bioresorbierbarkeit. Ziel der Studie ist die biomechanische Testung eines innovativen Paste-CPC bei der Schraubenaugmentation, als ein biokompatibles, abbaubares, synthetisch hergestelltes Knochenersatzmaterial, das bislang zum Auffüllen von Knochendefekten in nicht lasttragenden Bereichen verwendet wird. Hauptvorteil des pastösen Zementes ist die Vereinfachte Anwendung, da er ohne vorherige Vorbereitung direkt um das Osteosynthesematerial appliziert werden kann.
Methodik:
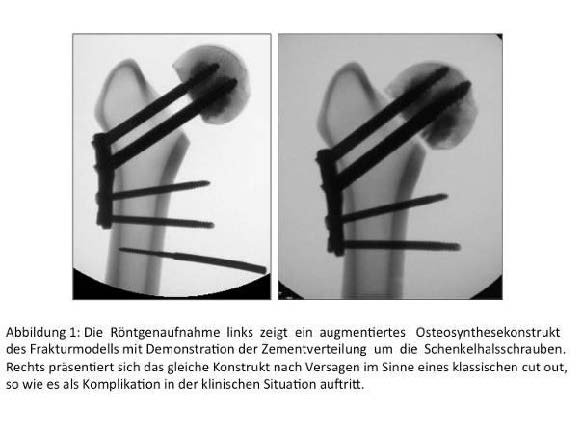
Es erfolgte der biomechanische Vergleich augmentierter und nicht augmentierter Konstrukte am Schenkelhalsfrakturmodell (n=5 Paare humaner Femora) nach Osteosynthese mit dem Implantat Targon FN (Aesculap, Abb. 1). Für die Augmentation mit 1ml CPC pro Schraube wurden vom Hersteller kanülierte Prototypen entwickelt. Nach Aushärtung des CPC erfolgte die dynamische axiale Belastung der Konstrukte (Prüfmaschine Amsler 10, Zwick&Roell) bis zur Entwicklung eines Versagens (cut out, Abb. 1). Zusätzlich erfolgten die ultraschallbasierte dreidimensionale Dokumentation der Dislokation (CMS 20, Zebris) sowie die kontinuierliche Aufzeichnung der Deformation der Proben mit der Software der Prüfmaschine (TestExpertR, Zwick&Roell).
Ergebnisse:
Die augmentierten Konstrukte zeigten i.V. zu den nicht augmentierten eine höhere Anzahl der Zyklen bis zum Versagen. Die Anzahl der Wechsellasten bis zur 5mm-Deformität der Konstrukte war bei den augmentierten Implantaten ebenfalls deutlich höher, jedoch nicht signifikant (80.000 vs. 59.000 Zyklen, p=0,243). Exemplarisch zeigte sich nach 40.000 Wechsellasten eine durchschnittliche Deformation der Konstrukte von 1,9mm vs. 3,3mm zu Gunsten der augmentierten Gruppe (p=0,246). Auch die ultraschallbasierte Messung der Dislokation zeigte zwar eine Überlegenheit der augmentierten Konstrukte, der Unterschied erreichte allerdings keine statistische Signifikanz.
Schlussfolgerung:
Es zeigte sich eine Tendenz zur Steigerung der Stabilität am Implantat-Knochen-Interface nach Augmentation mit CPC im Frakturmodell. Durch technische Optimierung der Applikation kann die Zementverteilung verbessert werden, was auch zu signifikanten Unterschieden i.V. zu nicht augmentierten Konstrukten führen könnte. Die Biokompatibilität, Resorbierbarkeit und deutlich leichtere Handhabung in Vergleich zum PMMA eröffnen eine vielversprechende Alternative zur Augmentation von Osteosynthesen.
V67
Abhängigkeit der Korrosionsratenberechnung magnesiumbasierter Implantate von der Analysemethode
*N. Angrisani1, A.- K. Marten1, R. Eifler2, A. Weizbauer3, J. Reifenrath1,3
1Stiftung Tierärztliche Hochschule Hannover, Klinik für Kleintiere, Hannover, Deutschland
2Leibniz Universität Hannover, Institut für Werkstoffkunde, Hannover, Deutschland
3Medizinische Hochschule Hannover, CrossBIT, Verbundzentrum für Biokompatibilität und Implantatimmunologie in der Medizintechnik, Hannover, Deutschland
Einleitung:
Zur Beurteilung der Degradationsgeschwindigkeit von Magnesiumlegierungen werden unterschiedliche Methoden genutzt. Der Vergleich der Resultate ist dabei häufig schwierig. In der vorliegenden Untersuchung wurde daher die Korrosionsrate der Magnesiumlegierung Mg-La-Nd-Zr durch in vitro und in vivo Methoden vergleichend bestimmt.
Materialien und Methoden:
Für die in vitro Untersuchung wurden jeweils acht Quader (5 × 4 × 4 mm) in Hank´s Balanced Salt Solution bzw. Roswell Park Memorial Insitute 1640 + 10% FBS Medium für 24 h bzw. 7 Tage inkubiert. Im Anschluss wurden die Proben getrocknet und die Korrosionsschichten durch eine Chromsäurebehandlung entfernt. Die Korrosionsratenbestimmung erfolgte anschließend mittels Berechnung des Gewichtsverlusts. Für die Versuche im Tiermodell wurden stranggepresste zylindrisch gedrehte Pins (Ø1.5 mm; Länge 7 mm) subkutan, intramuskulär und intramedullär (je n=6) in weibliche Lewis Ratten implantiert. Während des postoperativen Follow-Ups von acht Wochen wurden die Tiere wöchentlich im μ-Computertomographen (μCT, XtremeCT, Auflösung 41μm) untersucht. Im Anschluss an die Euthanasie erfolgte nach Chromsäurebehandlung neben einer wiederholten Messung im XtremeCT eine weitere μCT Untersuchung in einem höher auflösenden ex vivo Gerät (μCT80, Auflösung 18μm). Die Bestimmung der Korrosionsrate erfolgte ex vivo einerseits mittels Berechnung des Gewichtsverlusts, andererseits durch den Volumenverlust auf Basis der verschiedenen μCT-Scans.
Ergebnisse und Diskussion:
Erwartungsgemäß beeinflusste die Implantatlokalisation die in vivo Degradationsrate deutlich (intramedullär ≫ subkutan > intramuskulär). Die Korrosionsratenbestimmung mittels ex vivo μCT nach Chromsäurebehandlung der intramedullär implantierten Pins entsprach grundsätzlich der Berechnung mittels des Gewichtsverlusts nach in vitro Korrosion, wobei die Korrosion im Medium etwas schneller fortschritt. Obwohl Verlaufscans mit einem in vivo μCT wertvolle Daten zum Ablauf der Degradation von Magnesiumimplantaten liefern, liegt die ermittelte Korrosionsrate aufgrund der unzureichenden Abgrenzung der Degradationsschicht unterhalb der tatsächlich durch Gewichtsverlustmethode ermittelten Korrosionsrate. Insgesamt zeigen die Ergebnisse die deutliche Abhängigkeit der ermittelten Korrosionsrate von der Analysenmethode.
V68
Minimally-invasive, medial parapatellar approach for the treatment of osteochondral defects in the large animal model sheep
*L. Xin1,2, J. Mika3, S. Bischoff4, H. Schubert4, J. Adolph4, T. Vogl5, V. Kopsch1, R. W. Kinne1
1Jena University Hospital, Waldkrankenhaus “Rudolf Elle”, Experimental Rheumatology Unit, Department of Orthopedics, Eisenberg, Deutschland
2Tongde Hospital of Zhejiang Province, Department of Orthopedics, Hangzhou, Zhejiang, Deutschland
3Justus-Liebig-University, Department of Trauma Surgery, University Hospital Giessen and Marburg, Giessen and Laboratory of Experimental Trauma Surgery, Giessen, Deutschland
4Jena University Hospital, Institute of Laboratory Animal Sciences and Welfare, Jena, Deutschland
5Arthrex GmbH, Karlsfeld, Deutschland
Introduction:
Due to anatomical and biomechanical similarities, the ovine stifle joint represents a useful model for osteochondral (OC) defects in the human knee joint. Surgical access to the stifle joint via a medial or lateral approach usually requires large wound incisions and, depending on the OC implant site, luxation of the patella. This study thus aimed at a minimally-invasive approach for the generation and treatment of OC defects in the ovine stifle joint.
Materials and Methods:
Using the anatomical landmarks distal patella pole, tuberositas tibiae, and fossa intercondylaris, a medial, 4-5 cm long, parapatellar skin incision was placed from the level of the distal patella pole to a level approx. 2 cm distal of the tuberositas tibiae. Without luxation of the patella, a smaller medial incision (2-3 cm) through subcutaneous tissue and joint capsule was then applied to expose the medial femoral condyle, using two Hohmann retractors and limited resection of the infrapatellar fat pad to access the condyle and taking great care to avoid cartilage damage. Two defects (7 mm diameter and 10 mm depth) were created using a standardized OC punch (OATS, osteochondral autologous transplantation, Arthrex, USA), either left empty (empty control) or refilled with the original OATS cylinder (verum) and explanted after 6 weeks. Trauma/functional impairment and surgical techniques were documented by intra-operative incision-to-suture/anesthesia time and post-operative trauma/impairment scores, implant performance was judged by histology and immunohistology (IHC) for collagens 1 and 2, and aggrecan.
Results and Discussion:
The new surgical technique resulted in short operation (approx. 0.5 h) and anesthesia times (approx. 1.5 h), as well as a low wound trauma score (0.34 of max. 3) and post-operative time to complete stand (1.5 h). Histology and IHC showed largely incomplete healing of the empty defect with signs of dedifferentiation or heterotopic differentiation; in contrast, the verum defect filled with the OATS cylinder displayed advanced healing of the bone part with remaining gaps at the cartilage level and orthotopic expression of the respective bone and cartilage markers.
The minimally-invasive, medial parapatellar approach for the treatment of osteochondral defects in the large animal model sheep thus allows a faster and less traumatic surgical procedure with rapid post-operative recovery and appears well-suited for the testing of the performance of OC implants.
Figure 1
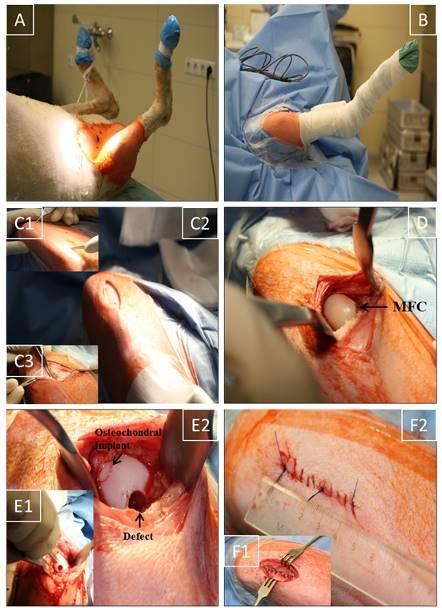
Surgical technique. (A) Sheep positioning in a supine position; (B) Sterile operation field (approx. 15 cm2) around the stifle joint; (C1,2) Medial, 4-5 cm long, parapatellar skin incision from the distal patella pole to approx. 2 cm proximal of the tuberositas tibiae; (C3) Smaller medial incision (2-3 cm) through subcutaneous tissue and joint capsule without luxation of the patella; (D) Exposure of medial femoral condyle (MFC); (E1,2) maximal flexion of the stifle joint; creation of 2 defects (7 mm diameter and 10 mm depth) in the main weight-bearing region of the MFC using a standardized osteochondral punch (OATS); empty defect or OATS-refilled defect; (F1,2) Layer-wise suturing of synovial capsule (interrupted sutures), subcutaneous tissue and skin (continuous sutures); approx. 4 cm long skin suture.
V69
Periostale Präfabrikation von vaskularisiertem Knochenersatzmaterial
*F. Duttenhoefer1, R. Schmelzeisen1, G. Giessler2
1Universitätsklinikum Freiburg, Klinik für Mund-, Kiefer und Gesichtschirurgie, Freiburg, Deutschland
2Klinikum Kassel, Klinik für Plastisch- Rekonstruktive, Ästhetische und Handchirurgie, Kassel, Deutschland
Einleitung:
Tissue Engineering auf Basis individuell gefertigter Knochenersatzmaterialien bietet heute potentielle Alternativen zum Goldstandard autologer Knochentransplantate. Dennoch zählt die initiale Neovaskularisation nach wie vor zu den wichtigsten limitierenden Faktoren dieser Implantate.
Ziel der vorliegenden Studie ist die Evaluation des Neovaskularisierungs- und Knochenneubildungspotenzials eines autologen artifiziellen Raums (Bioreaktor) zwischen der medialen Femurkondyle und deren Periost, der die Präparation eines gestielten Periostlappens direkt auf ein bioresorbierbares Knochenersatzmaterial ermöglicht.
Materialien und Methoden:
In 4 adulte Schafe wurde jeweils ein PEEK-basierter Bioreaktor, zwischen der medialen Femurkondyle und deren Periost implantiert. Die Schafe wurden in 2 Gruppen separiert: In Gruppe 1 (n=2) wurde der Bioreaktorraum mit einem bioresorbierbaren β-Trikalziumphosphat (β-TCP) Scaffold gefüllt, Kontrollgruppe 2 blieb ungefüllt. μCT Scans erfolgten sofort postoperativ sowie nach 12 wöchiger Einheilungsphase. Fluorochromemarkierung zur Dokumentation der Knochenneubildung erfolgte nach 4 (CalceinGreen) und 8 (XylenolOrange) Wochen. Nach 12 Wochen in situ wurden die Präparate histologisch ausgewertet (Giemsa Eosin, prämortale i.v. Tuscheinjektion).
Ergebnisse und Diskussion:
Die Fluorochromemarkierung zeigte bereits nach 4 Wochen eine Knochenneubildung im Bioreaktor. Bereits nach 12 Wochen ließ sich ein vermehrter Abbau und Ersatz des β-TCP Scaffolds durch neugebildeten Knochen sowie eine ausgedehnte Neovaskularisation ausgehend vom Periostlappen (Eosin-Giemsa, Tusche) nachweisen. 45% der ROI waren dabei knöchern durchbaut, mit einer Totalvolumenzumahme von 9% und einem Anstieg des Kalzifizierunglevels um 30% (μCT).
Zusammenfassung: Das Bioreaktorkonzept fördert in hohem Maße die Knochenneubildung und Neovaskularisation des Scaffoldmaterials. Darüberhinaus ist der neugebildete, vaskularisierte Knochen stark kalzifiziert und für eine Transplantation geeignet.
V70
Metallelemente im Gewebe mit Periimplantitis. Eine Pilotstudie.
*T. Fretwurst1, G. Buzanich2, S. Nahles3, J. P. Woelber4, H. Riesemeier2, K. Nelson1
1Universitätsklinikum Freiburg, Klinik für Mund-, Kiefer- und Gesichtschirurgie, Freiburg, Deutschland
2BAM - Bundesanstalt für Materialforschung und -prüfung, Bessy Berlin, Berlin, Deutschland
3Charite Berlin, Klinik für Mund-, Kiefer- und Gesichtschirurgie, Berlin, Deutschland
4Universitätsklinikum Freiburg, Klinik für Parodontologie, Freiburg, Deutschland
Einleitung:
Periimplantitis ist durch eine multifaktorielle Ätiologie charakterisiert. Die Rolle von Metallelementen als ein ätiologischer Faktor der Periimplantitis ist nach wie vor ungeklärt. Ziel dieser Pilotstudie war es, erstmalig das Vorhandensein von Metallelemente in humanen periimplantären Hart- und Weichgewebe, welche Zeichen einer Periimplantitis zeigen, nachzuweisen.
Materialien und Methoden:
Knochen- und Weichgewebeproben von Patienten mit Periimplantitis wurden auf das Vorhandensein von verschiedenen Elementen (Ca, Pa, Ti, Fe) mittels Röntgenfluoreszenzanalyse (synchrotron radiation x-ray fluorescence spectroscopy (SRXRF)) und Polarisationsmikroskopie (PLM) untersucht. Das Vorhandensein von Makrophagen, Lymphozyten und Osteoklasten im Gewebe wurde mittels Immunhistologie analysiert.
Ergebnisse und Diskussion:
12 Proben (7 Knochen- und 5 Weichgewebeproben) wurden in diese Studie eingeschlossen und analysiert. 9 von 12 Proben (75 %) zeigten mittels SRXRF eine erhöhte Titankonzentration und einige der Proben zeigten sogar eine Assoziation mit Eisen (Fe). Metallelemente waren in periimplantären Weichgewebe mittel PLM nachweisbar. In den Proben mit einer erhöhten Titankonzentration konnten M1 Makrophagen, Lymphozyten und Osteoklasten histologisch nachgewiesen werden.
Erhöhte Konzentrationen von Titan- und Eisenelementen wurden im Hart- und Weichgewebe von Biopsien gefunden, die eine Periimplantitis aufwiesen. Weitere histologische und immunhistochemische Untersuchungen müssen folgen, um zu klären, welche Immunreaktion Metallpartikel in periimplantären Gewebe induzieren.
©2015 by De Gruyter
Artikel in diesem Heft
- Frontmatter
- Vorträge
- Keynote Lecture I
- Drug-Delivery
- Keynote Lecture II
- Rapid Prototyping
- Young Scientist Forum
- Keynote Lecture III
- Biomaterialien I: Synthese und Charakterisierung
- Biokompatibilität I: in vivo und in vitro
- Biomaterialien II: Keramiken
- Biokompatibilität II: Grenzflächen
- Keynote Lecture IV
- Biomaterialien III: Oberflächen
- Biokompatibilität III: Scaffolds für den Gewebeersatz
- MSB-Net
- Klinische Anwendung
- Poster
- Biokompatibilität von Biomaterialien in vivo und in vitro
- Drug-Delivery-Systeme
- Grenzflächen Biosystem und Biomaterial
- Klinische Anwendung von Biomaterialien
- Oberflächen (Funktionalisierung, Beschichtung, Strukturierung)
- Rapid Prototyping/Additive Manufacturing
- Scaffolds für den Gewebeersatz
- Synthese und Charakterisierung von Biomaterialien (Polymere, Metalle, Keramiken, Komposite)
Artikel in diesem Heft
- Frontmatter
- Vorträge
- Keynote Lecture I
- Drug-Delivery
- Keynote Lecture II
- Rapid Prototyping
- Young Scientist Forum
- Keynote Lecture III
- Biomaterialien I: Synthese und Charakterisierung
- Biokompatibilität I: in vivo und in vitro
- Biomaterialien II: Keramiken
- Biokompatibilität II: Grenzflächen
- Keynote Lecture IV
- Biomaterialien III: Oberflächen
- Biokompatibilität III: Scaffolds für den Gewebeersatz
- MSB-Net
- Klinische Anwendung
- Poster
- Biokompatibilität von Biomaterialien in vivo und in vitro
- Drug-Delivery-Systeme
- Grenzflächen Biosystem und Biomaterial
- Klinische Anwendung von Biomaterialien
- Oberflächen (Funktionalisierung, Beschichtung, Strukturierung)
- Rapid Prototyping/Additive Manufacturing
- Scaffolds für den Gewebeersatz
- Synthese und Charakterisierung von Biomaterialien (Polymere, Metalle, Keramiken, Komposite)

