Zusammenfassung:
Vor dem Hintergrund der europäischen Harmonisierungsbemühungen hat die Schweizerische Gesellschaft für Mikrobiologie (SGM) den Laboratorien empfohlen, für die Durchführung und Interpretation der Antibiogramme ab 2011 die EUCAST-Richtlinien zu übernehmen. Die SGM-Arbeitsgruppe für die externe mikrobiologische Qualitätskontrolle hat sich zum Schweizerischen Komitee für das Antibiogramm erweitert, um die Laboratorien bei der Einführung von EUCAST zu unterstützen. In verschiedenen Weiterbildungen wurden die methodischen Veränderungen, aber auch das neue Konzept der Wildtyppopulation mit dem entsprechenden epidemiologischen Grenzwert mitgeteilt. Den klinischen Kollegen musste dargelegt werden, dass die früheren amerikanischen CLSI-Richtlinien sich teilweise den EUCAST-Richtlinien angenähert haben, insbesondere bei der Beurteilung der Beta-Laktamresistenz bei Gram-negativen Stäbchen (ESBL und Carbpenemasen). Auf Wunsch der Schweizerischen Gesellschaft für Infektiologie werden die mikrobiologischen Laboratorien weiterhin die Resistenzmechanismen angeben. Bis Ende 2012 haben über 80% der mikrobiologischen Laboratorien die EUCAST-Richtlinien eingeführt. Die Benennung von Expertenlaboratorien wird es ermöglichen, die neuen zunehmenden Resistenzmechanismen besser zu erfassen und die Öffentlichkeit darüber zu informieren.
Abstract:
In the light of European harmonization efforts, the Swiss Society for Microbiology (SSM) has recommended that Swiss laboratories perform and interprete all antibiograms from 2011 according to EUCAST guidelines. The SSM working group for external microbiological quality control has been expanded to the Swiss Antibiogram Committee to assist laboratories for the introduction of EUCAST. In various trainings and conferences, both methodological changes and the new concept of the wild-type population with epidemiological cut-off values were explained. Clinical colleagues were informed that the American CLSI guidelines have also accepted essential concepts of EUCAST guidelines, especially reporting of the resistances of Gram-negative rods to β-lactam antibiotics (ESBL and carbapenemases). However, microbiological laboratories will continue to specify the mechanisms of resistance as requested by the Swiss Society for Infectious Diseases. By the end of 2013, approximately 90% of microbiological laboratories will have adopted EUCAST guidelines. The designation of expert laboratories is a prerequisite to better detect emerging resistance mechanisms and to inform the public about it.
Rezensierte Publikation:
Schimanski S.
Einleitung
Vor dem Hintergrund der europäischen Harmonisierungsbemühungen hat die Schweizerische Gesellschaft für Mikrobiologie (SGM – www.swissmicrobiology.ch) bereits im Juni 2009 in Lausanne an ihrer Jahrestagung den schweizerischen Laboratorien empfohlen, ab dem Jahre 2011 für die Durchführung und Interpretation der Antibiogramme die Richtlinien von EUCAST (European Committee on Antimicrobial Susceptibility Testing – www.eucast.org) zu übernehmen. Prof. Dr. med. Jacques Bille war bereits längere Zeit im erweiterten Vorstand (General Committee) von EUCAST und konnte stetig die bei der Einführung der EUCAST Richtlinien zu erwartenden Änderungen in die Arbeitsgruppe für die externe mikrobiologische Qualitätskontrolle einbringen. Mitte 2010 wurde diese Arbeitsgruppe mit Vertretern der Schweizerischen Gesellschaften für Infektiologie und Spitalhygiene, Swissnoso und Anresis erweitert; Swissnoso (www.swissnoso.ch) ist ein Verein, welcher sich der Reduktion von nosokomialen Infektionen und multiresistenten Keimen im Schweizer Gesundheitswesen widmet; Anresis (www.anresis.ch) ist ein regionales und nationales Überwachungssystem und Forschungsinstrument für Antibiotikaresistenzen und Antibiotikakonsum im humanmedizinischen Bereich. Diese so erweiterte Arbeitsgruppe unter der Leitung von Prof. Bille wurde nun als Schweizerisches Komitee für das Antibiogramm (Swiss Antibiogram Committee – SAC) zum schweizerischen Ansprechpartner von EUCAST. Von Anfang an war auch ein Vertreter der Veterinärbakteriologie in der Gruppe und demnächst wird ebenfalls ein Vertreter der Lebensmittelmikrobiologie dazu kommen, weil neben den labortechnischen Aspekten auch generelle Probleme der Resistenzentwicklung besprochen werden; in diesem Zusammenhang spielen die Lebensmittel auch eine Rolle.
Die Hauptaufgabe des SAC war und ist die Unterstützung der Laboratorien bei der Einführung von EUCAST und die Information an die Ärzte, insbesondere auch an die Infektiologen; die Konsequenzen für die Antibiotikatherapie und Infektionskontrolle wurden in mehreren Veranstaltungen und Kongressen diskutiert. Die dabei gemachten Erfahrungen mit verschiedenen Fragen, aber auch Schwierigkeiten werden in den folgenden Kapiteln anhand von Beispielen dargelegt. Zusätzlich soll aber auch auf die Struktur von EUCAST eingegangen werden, welche es ermöglicht, dass selbst ein kleines Land außerhalb der EU seine Vorschläge einbringen kann. Die Methodik für das Labor hat teilweise massive Veränderungen erfahren; deshalb sollen diese konkreten Punkte ebenfalls dargestellt werden.
Organisation und Ziele von EUCAST
EUCAST besteht aus einem großen erweiterten Vorstand (General Committee) mit einem offiziellen Landesvertreter und einem kleineren "Steering Committee", welchem je ein Vertreter der sechs früheren nationalen Antibiotika-Komitees und zwei Delegierte des Vorstandes angehören. EUCAST pflegt enge Beziehungen mit der EMEA (European Medicines Agency) und dem ECDC (European Center for Disease Prevention and Control) und beruft ad-hoc Expertengruppen wie auch Untergruppen (Subkomitees) für Antimykotika und Resistenzmechanismen; solche Gruppen werden spezifisch für bestimmte Fragestellungen gebildet und nach Abgabe eines Dokumentes oder einer Publikation – wie zum Beispiel bei den Expertenregeln – wieder aufgelöst.
Die zwei Hauptziele von EUCAST sind:
die Erstellung der kritischen Werte (clinical breakpoints) für die bestehenden und zukünftigen antimikrobiellen Stoffe in Zusammenarbeit mit ESCMID, EMEA und ECDC
die Entwicklung von standardisierten Methoden zur Testung antimikrobieller Stoffe wie auch von Verfahren für die interne Qualitätskontrolle.
Weitere Ziele betreffen
die Erfassung der Verteilung der minimalen Hemmkonzentrationen (MHK) der Wildtypstämme (Wild Type MIC, siehe weiter unten) jeder Bakterien- und Pilzart
die Interaktion mit Organisationen wie EMEA, ECDC, EFSA (European Food Safety Authority) und EARSS (European Antimicrobial Resistance Surveillance System) und mit den nationalen Komitees, welche für die Bestimmung der Resistenzprüfungsverfahren zuständig sind.
Im Rahmen des jährlichen europäischen Kongresses für klinische Mikrobiologie und Infektionskrankheiten – ECCMID – organisiert EUCAST jeweils einen halbtägigen Workshop und weitere Veranstaltungen, bei denen die neuesten Entwicklungen und geplanten Änderungen des kommenden Jahres dargestellt werden. Die jeweiligen Landesvertreter werden zusätzlich in der Sitzung des erweiterten Vorstandes über die wichtigsten strategischen Pläne informiert. Die Landesvertreter, welche nicht im Steering Committee sind, können sich sogar bewerben, an deren Sitzungen teilzunehmen. Auch außerhalb dieses Kongresses können die Landesvertreter, aber auch Einzelpersonen bei EUCAST Fragen stellen, welche dann individuell beantwortet werden. Auf der Homepage von EUCAST werden dann häufig gestellte Fragen von allgemeinem Interesse mit den offiziellen Antworten publiziert und allenfalls in einem der nächsten Workshops an der ECCMID besprochen.
Methodik von EUCAST
EUCAST verfolgt einen komplexen Weg, um die kritischen Grenzwerte (clinical breakpoints) zu bestimmen; es werden mehrere Parameter berücksichtigt:
die Dosierung oder die Dosierungen des betreffenden Antibiotikums
der Zielmikroorganismus
die Verteilung der MHK bei den Zielmikroorganismen ohne einen phänotypischen Resistenzmechanismus, d.h. die Verteilung der MHK bei den Wildtypstämmen oder “wild type distribution“; dieses Konzept ist grundlegend für EUCAST
das zweite grundlegende Konzept von EUCAST ist, dass diese sogenannte Wildtyppopulation nicht künstlich durch die kritischen Grenzwerte in 2 Gruppen geteilt werden darf; diese Verteilung der MHK der Wildtypstämme definiert die maximale MHK, welche bei Stämmen einer gegebenen Spezies ohne Resistenzmechanismus vorkommen kann; dieser MHK-Wert wird ECOFF für Epidemiological CutOFF genannt; nach Möglichkeit wird der klinische Breakpoint beim ECOFF gesetzt, wenn nicht andere Faktoren dagegen sprechen (Abbildung 1)
die Resistenzmechanismen mit den entsprechenden MHK
die klinischen Indikationen
die pharmakokinetischen (Cmax, AUC, T½, Proteinbindung, Verteilungsvolumen) und pharmakodynamischen Werte (Cmax/CMI, AUC/CMI, Monte Carlo Simulation)
das klinische Ansprechen in Abhängigkeit der gegebenen MHK.
Diese neue Methodik, die klinischen Grenzwerte zu erarbeiten, musste also auch den Infektiologen und klinischen Kollegen erklärt werden, weil sie ja schlussendlich dann die Resultate von den Laboratorien entgegen nehmen. In einer ersten gemeinsamen Weiterbildung im Januar 2011 konnten wir den Kollegen der Infektiologie erklären, wieso wir auf die neuen Richtlinien wechseln. Folgende Vorteile von EUCAST gegenüber den amerikanischen Standards (Clinical and Laboratory Standards Institute – CLSI, früher National Committee for Clinical Laboratory Standards-NCCLS) wurden kommuniziert:
die EUCAST-Richtlinien basieren auf den von der EMEA zugelassenen Indikationen der Antibiotikatherapie und auf den in Europa üblichen Dosierungen
sie sind unabhängiger von kommerziellen Interessen, transparent und nachvollziehbar
sie sind im Gegensatz zu den CLSI – Unterlagen unentgeltlich auf einer öffentlichen Website zugänglich
sie können regelmäßig aufgrund einfacher Vorstöße von mehreren Partnern (EMEA, EUCAST, pharmazeutische Firmen) verändert werden.
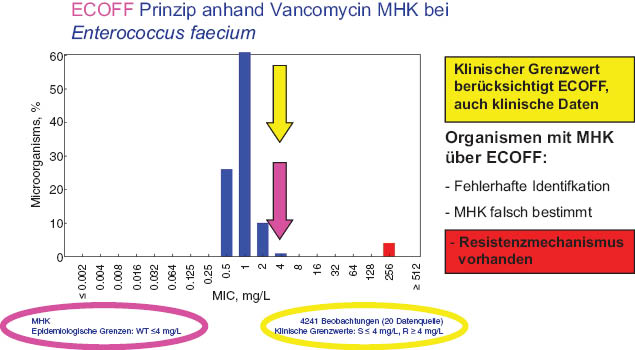
Prinzip von ECOFF.
In einer gemeinsamen Jahresversammlung und im Januar 2012 und 2013 konnten wir spezielle Fragen wie auch die klinischen und epidemiologischen Auswirkungen der neuen Richtlinien diskutieren. Die schweizerische Gesellschaft für Infektiologie konnte ihre Wünsche bei diesen Diskussionen einbringen und sie haben im Gegenzug unsere Fragen entgegen genommen, welche nach und nach geklärt werden müssen. Die wichtigsten Vorträge wurden auch auf der Homepage der SGM für alle zugänglich gemacht. Ein wichtiges Argument für den Wechsel auf EUCAST war, dass sich die Richtlinien von CLSI 2010 sehr stark an EUCAST angenähert haben, z. B. die neue Art, bei den Gram-negativen Stäbchen nicht primär die Resistenzmechanismen zu suchen, sondern die Resultate so abzugeben, wie sie nach den neuen – oft strengeren – klinischen Grenzwerten abgelesen wurden. Die Schweizerische Gesellschaft für Infektiologie hat von den Laboratorien offiziell verlangt, dass wir weiterhin die Resistenzmechanismen angeben, damit in einer Übergangszeit die Ärzte selber entscheiden können, ob sie zum Beispiel eine Escherichia coli mit einer Extended Spectrum Beta-Lactamase (ESBL) mit einem empfindlich getesteten Cephalosporin oder Piperacillin/Tazobactam behandeln wollen. Bis Ende 2014 werden wir dem Wunsch der Angabe des Resistenzmechanismus nachkommen, vielleicht auch darüber hinaus. Auf der anderen Seite müssen die Infektiologen auch bereit sein, bei nicht lebensbedrohlichen Infektionen mit ESBL auf Carbapenemen zu verzichten. Wir erwarten also im Gegenzug von den Infektiologen, dass sie unseren Kampf gegen die zu schnelle Gabe von Carbapenemen unterstützen.
Einführung von EUCAST in den Laboratorien
Die standardisierte in vitro Bestimmung der Empfindlichkeit von Bakterien gegenüber Antibiotika ist unerlässlich, um einerseits direkt die Antibiotikatherapie des einzelnen Patienten und anderseits indirekt dank der Kenntnis der lokalen Antibiotikaresistenzlage die empirische Therapie zu steuern. Die erhobenen Daten sind auch nützlich, die Resistenzentwicklung auf lokaler (Spital) und nationaler Ebene zu verfolgen. Die Interpretation dieser Teste und die Angabe der Resultate (E für empfindlich, R für resistent, I für intermediär) an den Kliniker erfolgten in der Schweiz seit über 30 Jahren nach den klinischen Grenzwerten (clinical breakpoints) von CLSI (früher NCCLS). Diese Ausrichtung nach diesen amerikanischen Standards war sicher ein weiser Entscheid der damaligen Entscheidungsträger, weil einerseits diese Standards jedes Jahr den neuen Gegebenheiten angepasst wurden und anderseits sich die verschiedenen Regionen der Schweiz sonst wohl den Richtlinien der jeweiligen Nachbarländer angeschlossen hätten. In Europa hatten ja viele Länder ihre eigenen Methoden und Beurteilungskriterien entwickelt (BSAC in Großbritannien, CA-SFM in Frankreich, CRG in den Niederlanden, DIN in Deutschland, NWGA in Norwegen und SRGA in Schweden). Die Umstellung von den amerikanischen auf die europäischen Richtlinien ist nun 2010 möglich geworden, weil erstmals von EUCAST-Tabellen mit klinischen Breakpoints publiziert wurden. Die Umstellung musste aber auch den Laboratorien erklärt werden. Für diesen Zweck hat das SAC mehrere Informationsveranstaltungen organisiert (SGM-Jahresversammlung 2009 in Lausanne; Treffen der Diagnostik in Medizinischer Mikrobiologie, Juni 2010 in Bern; Workshop mit Hilfe von Derek Brown von EUCAST, September 2011 in Bern, mit anschließenden praktischen Kursen in Lausanne und Zürich) und vergleichende Listen der CLSI und der EUCAST-Richtlinien erstellt (einsehbar unter www.swissmicrobiology.ch → EUCAST). Die Einführung in die Laboratorien wurde aber erleichtert, weil sich die CLSI-Richtlinien von 2010 sehr stark den EUCAST-Richtlinien angenähert haben, insbesondere die Handhabung der Testung von ESBL und AmpC bzw. der Erfassung der Carbapenemresistenzen. Bis Ende 2012 haben über 80% der Laboratorien die EUCAST-Richtlinien übernommen. Einige namhafte Laboratorien der Schweiz haben noch nicht umgestellt, weil sie teilweise mit der neuen Politik der Testung für ESBL nicht einverstanden sind und zum Teil noch die Praxis von CLSI 2009 anwenden möchten, bei der bei ESBL alle Cephalosporine – auch wenn empfindlich getestet – als resistent betrachtet werden. Es gibt aber durchaus Veränderungen der Methodik im Labor, welche doch einen erheblichen Aufwand nach sich ziehen.
Auswirkungen für das Labor
EUCAST hat im Wesentlichen die phänotypischen Methoden wie die Bestimmung der MHK mittels Fest- oder Flüssigmedien standardisiert; dazu gehören die kritischen Hemmhöfe im Blättchendiffusionstest und die Anpassungen für Automaten (Vitek, Phoenix, Microscan). Diese Methoden sind reproduzierbar, quantifizierbar und sagen eine Empfindlichkeit oder Resistenz voraus.
EUCAST erstellt für jedes Antibiotikum und jeden Zielmikroorganismus Tabellen. Im Vergleich zu den CLSI Tabellen, gibt EUCAST für die kritischen MHK-Werte (breakpoints) “≤X μg /mL” für E (empfindlich) und “> Y μg/mL” für R (resistent) und sinngemäß für die Hemmhöfe “"≥ X mm” für E (empfindlich) und “< Y mm” für R (resistent) an (siehe Tabelle 1). Bei den mm ist diese Schreibweise eher unnötig, macht aber für die MHK mathematisch Sinn; die früheren MHK-Bestimmungen sind jeweils in Verdünnungen mit Zweierschritten erfolgt, so dass die Schreibweise von CLSI genügend war. Mit den E-tests gibt es aber auch Resultate, die dazwischen liegen; wenn zum Beispiel bei Ceftriaxon (siehe Tabelle 1) der MHK-Wert von 2 nach CLSI intermediär ist und der MHK-Wert von 4 als resistent gilt, dann weiß man bei einem Wert von 3 nicht, ob dieser Wert auch als intermediär gilt. Durch die neue Schreibweise bei EUCAST mit resistent >2 mg/L ist rechnerisch eindeutig, dass 3 als resistent gilt. Dies sind banale Veränderungen, welche aber auch computertechnisch umgesetzt werden müssen. Die EUCAST Tabellen sind auf der Internetseite von EUCAST (www.eucast.org) zugänglich und mit einem einfachen Klick auf den Namen des Antibiotikums kann das komplette Dokument, welches zu der Definition der kritischen Werte geführt hat, angeschaut werden. Alle Dokumente, welche für die Durchführung und Interpretation der Teste notwendig sind, befinden sich auf dieser Internetseite.
Kritische Grenzwerte für Ceftriaxon (mm, MHK), Cefepim (mm, MHK) und Ceftazidim (MHK).

Gelb → Die Grenzwerte von EUCAST 2012 sind gleich zu den Werten CLSI 2010/12. Grenzwerte von EUCAST 2012 sind strenger als diejenigen von CLSI 2010/12.
Die Anwendung der EUCAST-Richtlinien zieht im Vergleich zu den vorher von den meisten schweizerischen Laboratorien gültigen CLSI-Richtlinien wichtige Veränderungen nach sich. Diese betreffen vor allem zwei Aspekte:
Die hauptsächlichen Unterschiede zwischen EUCAST und CLSI betreffen die technischen Veränderungen (Kulturmedien, Konzentration der Antibiotika-Blättchen, Inkubationsbedingungen), welche vom Labor berücksichtigt werden müssen.
Für die Agardiffusionsmethode (disk diffusion) hat EUCAST mehrere Veränderungen eingeführt:
Anwendung zweier Festmedien für die Resistenztestung
Mueller-Hinton (MH) Agar für anspruchslose Bakterien
und
MH mit 5% Pferdeblut und 20 mg/L β-NAD (MHF) für die Streptokokken inklusive Streptococcus pneumoniae, Haemophilus spp. und andere anspruchsvolle Mikroorganismen
die Platten werden bei 35°C±1°C für 18±2 h im normalen Brutschrank (für die MH-Platten) oder im 5% CO2 Brutschrank (MH-F Platten) inkubiert
die Blättchenbeschichtung mit Antibiotika kann von derjenigen von CLSI abweichen; dies ist ein Punkt, welcher vielen Laboratorien praktisch Schwierigkeiten bei der Umstellung gemacht hat, weil man ja die alten Blättchen nicht einfach wegwerfen möchte.
Die Veränderungen in der Interpretation des Antibiogramms, welche durch die angepassten – in der Regel tieferen – kritischen Konzentrationen (breakpoints) zustande gekommen sind, ziehen eine erhöhte Anzahl von nicht empfindlich oder resistent berichteten Stämmen nach sich. Betroffen sind insbesondere Interpretationen von:
Glykopeptiden bei Staphylokokken und Enterokokken
Betalaktamen bei Enterobakterien
Aminoglykosiden bei den Staphylokokken und die hohe Aminoglykosidresistenz der Enterokokken
Penicillin bei den vergrünenden Streptokokken.
In vielen Situationen ergeben sich aber keine Veränderungen, z.B.
Methicillinresistenz bei Staphylococcus aureus und Koagulase-negativen Staphylokokken
Screening der Penicillinempfindlichkeit bei Pneumokokken
Regeln für Clindamycin bei der induzierbaren MLS-Resistenz.
Es muss betont werden, dass einige Schwierigkeiten der Messung an sich auch schon bei CLSI vorhanden gewesen sind, aber durch die Beschäftigung mit dem genauen Messen werden gerne die damit verbundenen Probleme mit der Einführung von EUCAST gekoppelt. Wir haben aber mit der externen mikrobiologischen Qualitätskontrolle die Möglichkeit, bestimmte Probleme bekannt zu machen. Im Folgenden wird anhand von einigen Beispielen gezeigt, wie sich die Mikrobiologen zusammen mit den Infektiologen damit auseinander setzen.
Testung der Penicillin-Empfindlichkeit bei Staphylococcus aureus
Erfreulich ist, dass die EUCAST Richtlinien einige ältere Methoden aufgenommen haben, die bereits über 20 Jahre an unserem Institut zur Anwendung kamen und ebenfalls in Deutschland bekannt waren. Für den Nachweis der Penicillin-Resistenz bei S. aureus war die Testung der Beta-Laktamase zentral, obwohl mehrere Publikationen gezeigt hatten, dass dieser Test – insbesondere im Blättchenverfahren – nicht sensitiv genug ist. EUCAST hat nun neben dem Messwert der Hemmzone auch die Beurteilung des Hemmzonenrandes (auslaufend bei negativer, scharf abgegrenzt bei positiver Beta-Laktamase) einbezogen. CLSI hat inzwischen diese Methodik auch übernommen. Diese neue Methode musste natürlich auch den Infektiologen erklärt werden, weil diese zum Teil in Amerika eine Zusatzausbildung erhalten hatten und immer die Beta-Laktamase als Zusatztest wollten.
Testung der Glykopeptid-Empfindlichkeit bei Staphylokokken
Infolge der allmählichen Zunahme des Anteils der S. aureus mit einer Methicillin-resistenz (MRSA mit entsprechender Resistenz gegen alle Beta-Laktame) steigt die Verwendung von Glykopeptiden (insbesondere von Vancomycin) auch bei uns in der Schweiz; dies insbesondere in der Westschweiz und im Tessin, wo die MRSA-Rate sehr hoch ist; deshalb ist die generelle Testung der Glykopeptide – zumindest im Spitalumfeld – notwendig. EUCAST und CLSI empfehlen für die Testung von Vancomycin bei Staphylokokken den Blättchen-Agardiffusiontest nicht, weil diese Methode nicht zwischen Isolaten mit einer vollen und einer reduzierten Empfindlichkeit (hVISA oder VISA) unterscheiden kann. Die Bestimmung der Empfindlichkeit gegenüber Teicoplanin ist nach CLSI noch zugelassen; wir haben an unserem Institut schon über Jahre das Teicoplanin anstelle von Vancomycin getestet und bei einer intermediären Zone die MHK von Teicoplanin und Vancomycin und weitere Teste durchgeführt. Da EUCAST bei Staphylokokken auch für Teicoplanin keine Hemmhöfe mehr vorschlägt, hat das SAC den Laboratorien vorgeschlagen, für S. aureus und S. lugdunensis den EUCAST-Grenzwert für Enterokokken von 16 mm anzuwenden, zumal der MHK-Grenzwert für Teicoplanin bei Enterokokken und S. aureus identisch ist, nämlich 2 mg/l. Der MHK Grenzwert für Teicoplanin ist bei Koagulase-negativen Staphylokokken (SKN) 4 mg/l. Ein Hemmhof-Grenzwert von 16 mm würde das Risiko beinhalten, dass zu viele MHK für schlussendlich Glykopeptid-empfindliche SKN durchgeführt werden müssten. Für SKN könnte ein Hemmhof-Grenzwert von 14 mm (CLSI) angewendet werden. Es wäre momentan mit der epidemiologischen Situation in der Schweiz nicht realistisch, dass man bei jedem Staphylokokken eine MHK für Vancomycin oder Teicoplanin durchführt.
Dies zeigt, dass das nationale Komitee teilweise abweichende Vorschläge machen kann, wenn dies der epidemiologischen Situation gerecht wird. Die Auswirkung dieser neuen Grenzwerte auf die Verwendung weiterer Reserve-Antibiotika wie Linezolid und Daptomycin und auf die Hygienemaßnahmen muss sorgfältig überwacht werden. Möglicherweise muss später dieser Weg korrigiert werden.
Enterokokken und Fluorochinolone
Im klinischen Alltag kommt es oft vor, dass man bei einem Harnwegsinfekt im Urin neben E. coli ebenfalls Enterokokken findet und beide Erreger gleichzeitig behandeln will; dazu bieten sich oft Fluorochinolone an. Als wir den Infektiologen mitteilten, dass EUCAST für Enterokokken keine Chinolone vorsieht und dass man Chinolone, wenn verlangt, resistent setzen soll, war natürlich sofort der Verdacht einer gewissen Abgehobenheit der EUCAST-Richtlinien im Raum; bei CLSI sind durchaus Werte für Levofloxacin vorhanden. EUCAST hat dieses Problem erkannt und ist nun daran, klinische Grenzwerte für Chinolone bei Harnwegsinfektionen mit Enterokokken zu erstellen. In einer öffentlichen Konsultation wurde die Verteilung der MHK mit entsprechendem ECOFF bekannt gegeben und die klinischen Grenzwerte vorgeschlagen. Nach Abschluss der Konsultation werden die entsprechenden Dokumente offiziell und spätestens im Januar 2014 werden die Werte in die EUCAST-Tabellen integriert. Dies zeigt, dass bei offensichtlichen Lücken EUCAST sehr schnell reagieren kann und allen Interessierten die Möglichkeit gibt, sich zu äußern.
Gram-negative Stäbchen und Beta-Laktame
Die EUCAST-Richtlinien wie auch die CLSI-Richtlinien ab 2010 haben größere Veränderungen für die Interpretation der Resistenzprüfungsresultate der Beta-Laktame bei Gram-negativen Stäbchen vorgeschlagen. Bis anhin hat man initial verschiedene Cephalosporine mit der Blättchenagardiffusion oder der Mikrodilution getestet und bei reduzierter Empfindlichkeit mit einem phänotypischen Bestätigungstest nach ESBL gesucht. Bei einem positiven Bestätigungstest, d. h. im Wesentlichen Hemmung durch Clavulansäure, wurden alle Penicilline, Cephalosporine und Aztreonam „resistent“ gesetzt. Dieses Vorgehen hat jeweils das definitive Resultat verzögert.
Sowohl CLSI 2010-2012 als auch EUCAST schlagen nun tiefere Grenzwerte vor (Tabelle 1), welche sowohl einen besseren primären Nachweis von ESBL, aber auch von anderen Resistenzmechanismen erlauben, die unter Umständen für die Klinik und die Epidemiologie noch wichtiger sind. Dadurch ist es an sich streng genommen für das Labor nicht mehr erforderlich, mit Zusatztesten systematisch das Vorhandensein von ESBL zu suchen; zudem ist es nicht mehr nötig, alle Beta-Laktame als inaktiv zu betrachten („report what you measure“).
Sowohl EUCAST als auch CLSI betonen, dass die Suche nach ESBL aus epidemiologischer und spitalhygienischer Sicht nützlich sein kann. Wie oben erwähnt, hat auf Wunsch der Schweizerischen Gesellschaft für Infektiologie das SAC empfohlen, weiterhin systematisch die Mechanismen anzugeben. Inzwischen ist ebenfalls eine Arbeitsgruppe von EUCAST daran, Richtlinien zum Erfassen von Resistenzmechanismen zu erstellen.
Es ist zu erwähnen, dass bei Augmentin – wie auch für andere Beta-Laktamae – für die Enterobacteriaceae die intermediäre Zone bei EUCAST entfernt wurde. Dies führt aber dazu, dass kleine Messabweichungen der mm um den klinischen Grenzwert sehr schnell zu falsch empfindlichen Resultaten führen können (very major error). Wir haben dieses Problem an einem Kongress mit den Infektiologen diskutiert. Es könnte durchaus sinnvoll sein, Messresultate quantitativ unter Angabe des entsprechenden Grenzwertes anzugeben, damit der Arzt sieht, dass die Messung um den Grenzwert liegt; in der klinischen Chemie und Hämatologie werden die Resultate ja ähnlich dargestellt. Die Infektiologen könnten sich dies auch vorstellen. Die Umsetzung würde aber die mikrobiologischen Berichte unübersichtlicher erscheinen lassen. Es wäre ja schon hilfreich, mit einer hochgestellten Markierung neben dem S-Resultat darauf hinzuweisen, dass der Messwert nahe beim Grenzwert ist; in kritischen Fällen könnte ja dann die Bestimmung der MHK eine Zusatzinformation geben. Am ECCMID 2013 in Berlin wurden durchaus ähnliche Ansätze diskutiert. Auch hier zeigt sich wieder, dass die Probleme sehr schnell gemeinsam diskutiert werden können. Zudem hat EUCAST insbesondere bei Augmentin Schwierigkeiten erkannt und wird die Grenzwerte überarbeiten.
Die Herabsetzung der Grenzwerte für Carbapeneme bei EUCAST und CLSI (siehe Tabelle 2) haben analog dazu geführt, dass die Screeningteste für den Nachweis von Carbapenemasen (z.B. modifizierter Hodge-Test) nicht mehr strikt notwendig sind, weil die Mehrzahl der Stämme mit Carbapenemasen oder anderen Resistenzmechanismen gegen Carbapenemen auf Anhieb mit den primären Testen als nicht sensibel erkannt wird.
Kritische Grenzwerte für Ertapenem (mm, MHK), Imipenem (mm, MHK) und Meropenem (mm, MHK).

Gelb → Die Grenzwerte von EUCAST 2012 sind gleich zu den Werten CLSI 2010/12. Grenzwerte von CLSI 2012 sind strenger als diejenigen von EUCAST 2012.
Auch hier kann gemäß EUCAST und CLSI aus epidemiologischen Gründen und Infektionskontrollmaßnahmen der Nachweis von Carbapenemasen gerechtfertigt sein. Das SAC empfiehlt, weiterhin die Anwesenheit von Carbapenemasen bei Vorliegen einer MHK über dem empfindlichen Grenzwert zu suchen.
Die oben erwähnte Arbeitsgruppe von EUCAST ist ebenfalls daran, Richtlinien zum Erfassen der Carbapenemasen zu erstellen. Allerdings sind diese Methoden nicht einfach für alle Labors zugänglich. Deshalb ist die Schweizerische Gesellschaft für Mikrobiologie über das SAC dabei, ein Netz von Expertenlaboratorien zu schaffen, damit auch kleinere Laboratorien mit weniger technischen Möglichkeiten, die Stämme weiter schicken können, um im ganzen Land die auftretenden Enterobacteriaceae mit Carbapenemasen zu erfassen. Leider wurden wir in den letzen 8 Jahren mit einer Zunahme von ESBL überrollt und die Zahlen wurden nicht systematisch früh genug erfasst. Wahrscheinlich hätten wir gegen diese „ESBLosion“ auch nichts unternehmen können; möglicherweise hätten wir aber die Bevölkerung mit Zahlen für dieses Problem besser sensibilisieren können. Deshalb möchten wir die Situation der neuen Bedrohungen, wie die zunehmende Carbapenemresistenz eine ist, besser überwachen.
Schlussfolgerung
Vor 2010, d. h. vor der Verfügbarkeit der EUCAST Richtlinien, bildeten die Richtlinien nach CLSI einen international akzeptierten Standard; deren Übernahme durch die schweizerischen mikrobiologischen Laboratorien war daher sinnvoll. Mit der Einführung der EUCAST Richtlinien und der Bildung des „Swiss Antibiogram Committees“ (SAC) machte die Schweiz den nächsten Schritt in Richtung Standardisierung von Technik und Interpretation der Resistenzprüfung und stellt so die direkte Vergleichbarkeit der Ergebnisse mit denjenigen anderer europäischer Länder sicher. Durch die Vertretung des SAC in EUCAST ist zudem sichergestellt, dass die Schweiz auf die Weiterentwicklung und Verbesserung der Richtlinien direkt Einfluss nehmen kann. Die bisherigen Erfahrungen sind ermutigend, haben doch seit 2011 bis Ende 2012 über 80% der schweizerischen mikrobiologischen Laboratorien die EUCAST Richtlinien eingeführt. Mit der Benennung von Expertenlaboratorien werden wir genauere Daten über drohende Resistenzmechanismen erhalten und so die Ōffentlichkeit besser informieren können. Das neue Epidemiengesetz wird es ebenfalls in der Schweiz ermöglichen, die Meldung der Resistenzdaten gesetzlich zu verankern und die Bekämpfung der Resistenzprobleme zur Bundessache zu machen.
Interessenkonflikt
Die Autoren erklären, dass keine wirtschaftlichen oder persönlichen Interessenkonflikte bestehen.
©2013 by Walter de Gruyter Berlin Boston
This article is distributed under the terms of the Creative Commons Attribution Non-Commercial License, which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Artikel in diesem Heft
- Masthead
- Masthead
- Editorial
- Editorial “Infektiologie und Mikrobiologie (Schwerpunkt Bakteriologie)”
- Infektiologie und Mikrobiologie (Schwerpunkt Bakteriologie)/Infectiology and Microbiology (Focus Bacteriology)
- Erfahrungen mit der Einführung der EUCAST Antibiotika-Richtlinien durch die schweizerischen Laboratorien (2011–2013)
- MRGN: neue Klassifikation für multiresistente gramnegative Bakterien
- MRGN: New classification for multidrug-resistant Gram-negative bacteria
- Molekulargenetische und zytogenetische Diagnostik/Molecular-Genetic and Cytogenetic Diagnostics
- Applications and data analysis of next-generation sequencing
- Der Über-Code der DNA: epigenetische Mechanismen und deren Bedeutung für die Entstehung von Krankheiten
- Developments and insights into the analysis of the human microbiome
- 12. Jahrestagung der Sektion Molekulare Diagnostik der DGKL am 6. und 7. Juni 2013 in der Evangelischen Akademie Tutzing / Report on the 12th Annual Meeting of the Section of Molecular Diagnostics of the DGKL on 6th/7th June 2013 in Tutzing
- Labormanagement/Laboratory Management
- Stellung und Aufgaben der Deutschen Akkreditierungsstelle (DAkkS): Informationen zur Akkreditierung im Bereich der Laboratoriumsmedizin
- Neue Entwicklungen in der Laboranalytik für Klinische Studien zur Zulassung von Arzneimitteln– Good Clinical Laboratory Practice (GCLP)
- Buchbesprechung/Book Review
- Transfusion Medicine and Patient Safety
Artikel in diesem Heft
- Masthead
- Masthead
- Editorial
- Editorial “Infektiologie und Mikrobiologie (Schwerpunkt Bakteriologie)”
- Infektiologie und Mikrobiologie (Schwerpunkt Bakteriologie)/Infectiology and Microbiology (Focus Bacteriology)
- Erfahrungen mit der Einführung der EUCAST Antibiotika-Richtlinien durch die schweizerischen Laboratorien (2011–2013)
- MRGN: neue Klassifikation für multiresistente gramnegative Bakterien
- MRGN: New classification for multidrug-resistant Gram-negative bacteria
- Molekulargenetische und zytogenetische Diagnostik/Molecular-Genetic and Cytogenetic Diagnostics
- Applications and data analysis of next-generation sequencing
- Der Über-Code der DNA: epigenetische Mechanismen und deren Bedeutung für die Entstehung von Krankheiten
- Developments and insights into the analysis of the human microbiome
- 12. Jahrestagung der Sektion Molekulare Diagnostik der DGKL am 6. und 7. Juni 2013 in der Evangelischen Akademie Tutzing / Report on the 12th Annual Meeting of the Section of Molecular Diagnostics of the DGKL on 6th/7th June 2013 in Tutzing
- Labormanagement/Laboratory Management
- Stellung und Aufgaben der Deutschen Akkreditierungsstelle (DAkkS): Informationen zur Akkreditierung im Bereich der Laboratoriumsmedizin
- Neue Entwicklungen in der Laboranalytik für Klinische Studien zur Zulassung von Arzneimitteln– Good Clinical Laboratory Practice (GCLP)
- Buchbesprechung/Book Review
- Transfusion Medicine and Patient Safety

