Estudio de la estabilidad de la actividad lactato deshidrogenasa en plasma a distintas temperaturas: conservación post-analítica
-
Marta Gómez López
, Neila Rodríguez Roca
Estimado Editor,
Las condiciones de almacenamiento de las muestras son un factor clave en la pre-analítica y post-analítica del laboratorio clínico. Habitualmente, la conservación post-analítica de las muestras se realiza en refrigeración. El frío disminuye el metabolismo celular y reduce las reacciones de degradación de muchas magnitudes, pero puede no ser la condición de conservación óptima en todos los casos. Este parece ser el caso de la enzima lactato deshidrogenasa (LDH), aunque, en la bibliografía no existe un consenso claro acerca de la temperatura de conservación idónea. Por ello, decidimos realizar un estudio siguiendo el protocolo publicado por la Sociedad Española de Medicina de Laboratorio (SEQCML) [1], para determinar el límite de estabilidad de LDH en muestras de plasma a temperatura ambiente (TA) o refrigerada.
Se realizó un estudio preliminar con determinación basal y a las 48 horas, que es el tiempo de retención post-analítico habitual en nuestro laboratorio. Se fijó la diferencia máxima admisible (DMA) en función de las especificaciones de calidad del laboratorio (6,39%, error sistemático mínimo calculado según la fórmula de VB en la Base de Datos de la página de la SEQCML) [2].
Se utilizaron 3 muestras sobrantes de plasma heparina de litio y se hicieron 3 alícuotas de cada muestra; una alícuota basal, que se congeló a −80 °C inmediatamente (muestra basal) y dos alícuotas que se conservaron a TA y a 4−8 °C. Transcurrido el tiempo establecido, se conservaron todas las alícuotas a −80 °C. Posteriormente se descongelaron, se homogeneizaron y se analizaron en la misma serie. La actividad de LDH se determinó mediante método Lactatopiruvato según IFCC en el analizador Dimension Vista 1500 (Siemens Healthineers). Las determinaciones se efectuaron por sextuplicado considerando el cociente entre la DMA y la imprecisión analítica habitual en nuestro laboratorio (CV = 2,97%).
La pérdida de estabilidad se expresó mediante la diferencia porcentual (DP%) obtenida con la media de los replicados para cada muestra, según la ecuación DP% = Ttiempo − Tbasal/Tbasal × 100. Se observa que a TA no hay una variación significativa (DP% < DMA). En cambio, las muestras refrigeradas tienen una pérdida en torno al 12–15%, superior a la DMA (Tabla 1).
Resumen de resultados de estudio preliminar.
| Basal | Ta ambiente | Nevera | |
|---|---|---|---|
| Paciente 1 | |||
| Media | 591,83 | 611,50 | 518,00 |
| SD | 9,83 | 16,47 | 3,22 |
| CV% | 1,66 | 2,69 | 0,62 |
| DP% | 3,32 | −12,48 | |
| DMA% | 6,39% | 6,39% | |
| Paciente 2 | |||
| Media | 242,67 | 248,33 | 211,67 |
| SD | 3,20 | 5,16 | 3,44 |
| CV% | 1,32 | 2,08 | 1,63 |
| DP% | 2,34 | −12,77 | |
| DMA% | 6,39% | 6,39% | |
| Paciente 3 | |||
| Media | 259,17 | 251,83 | 219,00 |
| SD | 1,47 | 1,33 | 3,52 |
| CV% | 0,57 | 0,53 | 1,61 |
| DP% | −2,83 | −15,50 | |
| DMA% | 6,39% | 6,39% | |
-
DP, diferencia porcentual; DMA, diferencia máxima admisible.
Para definir el límite de estabilidad en refrigeración se efectuó un estudio extendido. Se utilizaron 10 muestras de plasma, de las que se hicieron siete alícuotas, correspondientes a cada uno de los tiempos estudiados: basal, 12, 24, 36, 48, 60 y 72 horas que se conservaron a 4–8 °C. Las alícuotas almacenadas en nevera se fueron congelando a −80 °C en cada tiempo de estudio. Transcurrido el tiempo establecido, todas las alícuotas se descongelaron, se homogeneizaron y se analizaron en la misma serie por duplicado.
Se define una ecuación de inestabilidad (DP% = −0,14 × tiempo(h)) ajustada por mínimos cuadrados, obteniendo un coeficiente de correlación de Pearson (R) de 0,87 y una pendiente significativamente distinta de cero. Según esta ecuación, hay una pérdida de estabilidad diaria del 3,4%. Es decir, para una DMA de 6,39% se obtiene un límite de estabilidad de 45 horas (Figura 1).
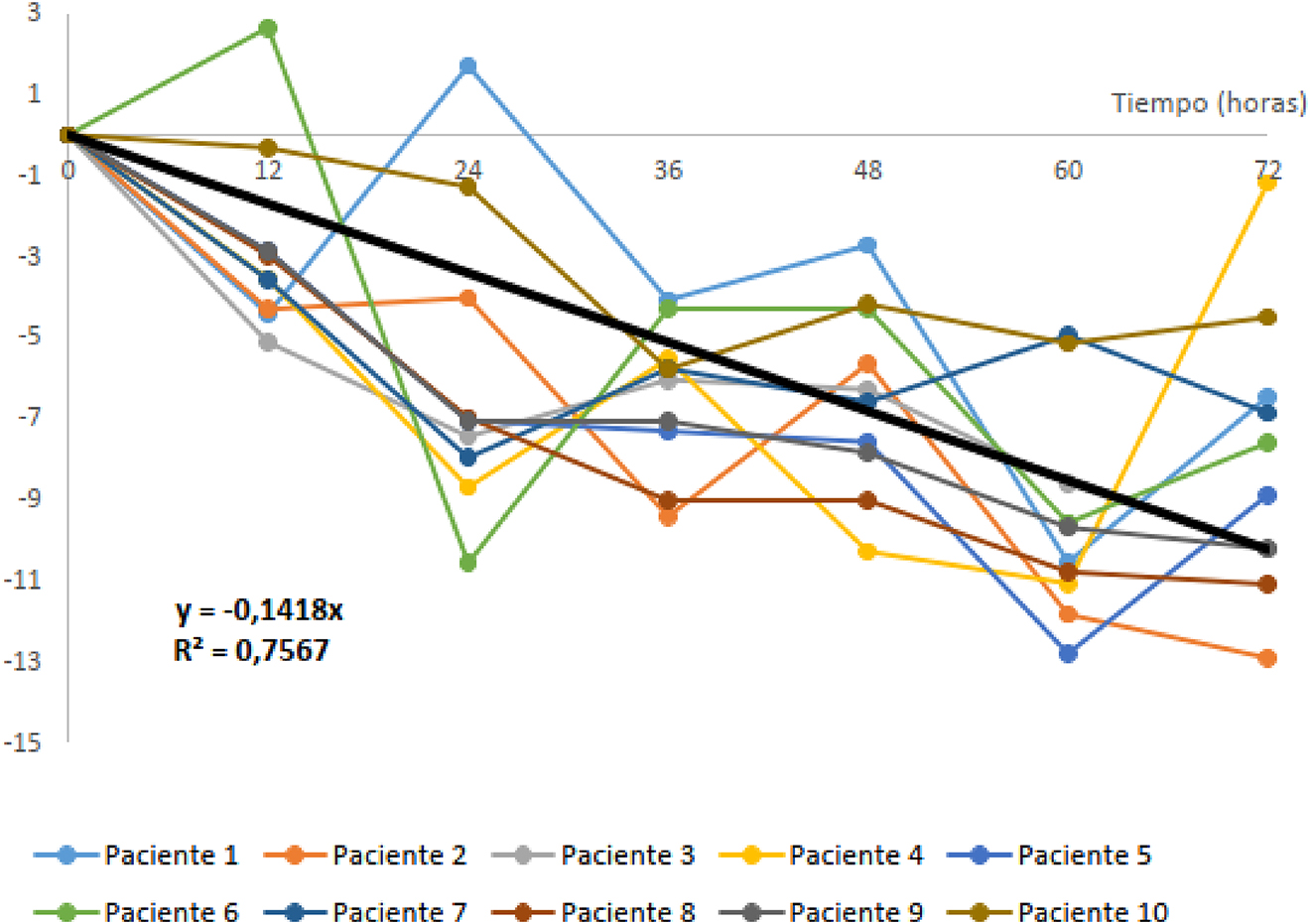
Representación gráfica del estudio extendido.
Nuestros resultados coinciden con lo que observan Shimizu Y, An B y Heins M, [3], [4], [5] que exponen que la actividad disminuye en muestras refrigeradas mientras que se mantiene estable a TA. Sin embargo, Oddoze C [6] observó un aumento de la actividad. Los límites de estabilidad mencionados oscilan entre 1 y 4 días, posiblemente en relación a los diferentes criterios de DMA que varían entre 3,53 y 7%.
La causa de la pérdida de estabilidad de la LDH en frío podría estar en la distinta termosensibilidad de las isoenzimas de la LDH. La LDH-4 y 5 son especialmente lábiles y posiblemente las responsables de la pérdida de actividad en frío [4]. Ésta podría ser también la explicación a la gran variabilidad interindividual observada y podría ser la causa de que los 3 pacientes incluidos en el estudio preliminar presentaran una pérdida de estabilidad ligeramente mayor a la predicha finalmente con el modelo extendido, que incluye un mayor número de pacientes.
La información sobre estabilidad de las magnitudes bioquímicas disponible es muchas veces confusa. La verificación de los límites de estabilidad en cada laboratorio permite asegurar la adecuación del límite de estabilidad a las condiciones particulares de cada laboratorio como el tipo de tubo, temperatura, luz o agitación. El estudio preliminar propuesto por la SEQCML permite confirmar la validez de un límite de estabilidad habitual, adaptado a la rutina del laboratorio, de forma simple y poco costosa. En caso de observarse posibles pérdidas de estabilidad la realización de un estudio extendido permite calcular una ecuación de inestabilidad que puede ser compartida con laboratorios que trabajen en condiciones similares.
-
Nota del artículo: La versión traducida del artículo puede encontrarse aquí: https://doi.org/10.1515/almed-2020-0077
-
Financiación de la investigación: No declarada.
-
Contribución de los autores: Todos los autores han aceptado la responsabilidad del contenido completo del manuscrito y aprueban su envío.
-
Conflicto de intereses: Los autores declaran no tener ningún conflicto de intereses.
-
Aprobación ética: La investigación realizada que incluya personas cumple con todas las regulaciones nacionales pertinentes y políticas institucionales, estando en total concordancia con los principios de la Declaración de Helsinki (tal y como se revisó en el año 2013) y ha sido aprobada por el Comité Ético Institucional u otro Comité equivalente.
Referencias
1. Gómez-Rioja R, Segovia Amaro M, Díaz-Garzón J, Bauçà JM, Martínez Espartosa D, Fernández-Calle P. A protocol for testing the stability of biochemical analytes. Technical document. Clin Chem Lab Med 2019;57:1829–36.10.1515/cclm-2019-0586Search in Google Scholar PubMed
2. SECQML. Base de datos de variación biológica de la Comisión de Calidad Analítica, 2014. Disponible en: http://www.seqc.es/es/comisiones/comision-decalidad-analitica/_id:4/.Search in Google Scholar
3. Shimizu Y, Ichihara K. Elucidation of stability profiles of common chemistry analytes in serum stored at six graded temperatures. Clin Chem Lab Med 2019;57:1388–96.10.1515/cclm-2018-1109Search in Google Scholar PubMed
4. Heins M, Heil W, Withold W. Storage of serum or whole blood samples? Effects of time and temperature on 22 serum analytes. Clin Chem Lab Med 1995;33:231–8.10.1515/cclm.1995.33.4.231Search in Google Scholar PubMed
5. An B, Park C-E. Evaluation of stability of serum on different storage temperatures for routine chemistry analytes. Kor J Clin Lab Sci 2014;46:111–6.10.15324/kjcls.2014.46.4.111Search in Google Scholar
6. Oddoze C, Lombard E, Portugal H. Stability study of 81 analytes in human whole blood, in serum and in plasma. Clin Biochem [Internet] 2012; 45:464–9.10.1016/j.clinbiochem.2012.01.012Search in Google Scholar PubMed
Material Suplementario
La versión en línea de este artículo ofrece material suplementario (https://doi.org/10.1515/almed-2020-0025).
© 2020 Marta Gómez López et al., published by De Gruyter, Berlin/Boston
This work is licensed under the Creative Commons Attribution 4.0 International License.
Articles in the same Issue
- Editorial
- Brief update on coronavirus disease 2019 (COVID-19) diagnostics
- Breve actualización sobre el diagnóstico de la enfermedad por coronavirus 2019 (COVID-19)
- Challenges of COVID-19
- Retos de la COVID-19
- Review / Artículo de Revisión
- SARS-CoV-2: a new threat
- SARS-CoV-2: una nueva amenaza
- VALIDA project: Validation of allergy in vitro diagnostics assays (Tools and recommendations for the assessment of in vitro tests in the diagnosis of allergy)
- Proyecto VALIDA: Validation of ALlergy In vitro Diagnostics Assays (Herramientas y recomendaciones para la valoración de las pruebas in vitro en el diagnóstico de la alergia)
- Original Article / Artículo Original
- Biomaker evaluation for major adverse cardiovascular event development in patients undergoing cardiac Surgery
- Evaluación del papel de diversos biomarcadores en el desarrollo de eventos cardiovasculares adversos mayores en pacientes sometidos a cirugía cardíaca
- CYFRA 21-1 in patients with suspected cancer: evaluation of an optimal cutoff to assess the diagnostic efficacy and prognostic value
- El CYFRA 21-1 en pacientes con sospecha de cáncer: evaluación de un punto de corte óptimo para evaluar la eficacia diagnóstica y el valor pronóstico
- Lactose tolerance test as an alternative to hydrogen breath test in the study of lactose malabsorption
- Estudio del test de tolerancia a lactosa como alternativa a test de hidrógeno espirado en el estudio de la malabsorción de lactosa
- Precision and trueness verification study of an Atellica system
- Estudio de verificación de precisión y veracidad en un sistema Atellica
- Case Report / Caso Clínico
- A variant of the gene HARS detected in the clinical exome: etiology of a peripheral neuropathy undiagnosed for 20 years
- Variante en gen HARS detectada en exoma clínico: etiología de neuropatía periférica tras más de 20 años sin diagnóstico
- Letter to the Editor / Carta al Editor
- Stability of lactate dehydrogenase in plasma at different temperatures: post-analytical storage
- Estudio de la estabilidad de la actividad lactato deshidrogenasa en plasma a distintas temperaturas: conservación post-analítica
Articles in the same Issue
- Editorial
- Brief update on coronavirus disease 2019 (COVID-19) diagnostics
- Breve actualización sobre el diagnóstico de la enfermedad por coronavirus 2019 (COVID-19)
- Challenges of COVID-19
- Retos de la COVID-19
- Review / Artículo de Revisión
- SARS-CoV-2: a new threat
- SARS-CoV-2: una nueva amenaza
- VALIDA project: Validation of allergy in vitro diagnostics assays (Tools and recommendations for the assessment of in vitro tests in the diagnosis of allergy)
- Proyecto VALIDA: Validation of ALlergy In vitro Diagnostics Assays (Herramientas y recomendaciones para la valoración de las pruebas in vitro en el diagnóstico de la alergia)
- Original Article / Artículo Original
- Biomaker evaluation for major adverse cardiovascular event development in patients undergoing cardiac Surgery
- Evaluación del papel de diversos biomarcadores en el desarrollo de eventos cardiovasculares adversos mayores en pacientes sometidos a cirugía cardíaca
- CYFRA 21-1 in patients with suspected cancer: evaluation of an optimal cutoff to assess the diagnostic efficacy and prognostic value
- El CYFRA 21-1 en pacientes con sospecha de cáncer: evaluación de un punto de corte óptimo para evaluar la eficacia diagnóstica y el valor pronóstico
- Lactose tolerance test as an alternative to hydrogen breath test in the study of lactose malabsorption
- Estudio del test de tolerancia a lactosa como alternativa a test de hidrógeno espirado en el estudio de la malabsorción de lactosa
- Precision and trueness verification study of an Atellica system
- Estudio de verificación de precisión y veracidad en un sistema Atellica
- Case Report / Caso Clínico
- A variant of the gene HARS detected in the clinical exome: etiology of a peripheral neuropathy undiagnosed for 20 years
- Variante en gen HARS detectada en exoma clínico: etiología de neuropatía periférica tras más de 20 años sin diagnóstico
- Letter to the Editor / Carta al Editor
- Stability of lactate dehydrogenase in plasma at different temperatures: post-analytical storage
- Estudio de la estabilidad de la actividad lactato deshidrogenasa en plasma a distintas temperaturas: conservación post-analítica

