Zusammenfassung
Seit der Einführung des flächendeckenden Neugeborenen-Screenings auf Phenylketonurie Ende der 60er Jahre in Deutschland, ist die Anzahl der Zielerkrankungen im sogenannten erweiterten Neugeborenen-Screening (ENS) stetig gestiegen. Aufgrund neuer diagnostischer Möglichkeiten, sowie neuer therapeutischer Ansätze bei schweren, seltenen Erkrankungen z. B. des Stoffwechsels, wird die Anzahl der Zielkrankheiten absehbar weiter steigen. Diese werden, unter Berücksichtigung der im vorliegenden Beitrag beschriebenen Grundvoraussetzungen, entweder Teil des erweiterten Neugeborenen-Screenings oder als eigenständiges Screening Teil der Sekundärprävention in Deutschland sein. Dieser Beitrag soll einen Überblick über Grundlagen des etablierten Neugeborenen-Screenings liefern sowie Einblicke in die Voraussetzungen für die Einführung neuer Zielerkrankungen in das Neugeborenen-Screening in Deutschland ermöglichen.
Abstract
Since the introduction of nationwide newborn screening for phenylketonuria in the 1960s in Germany, the number of target diseases in the so-called extended neonatal screening (ENS) has risen steadily. Due to new diagnostic possibilities, as well as new therapeutic approaches in severe, rare diseases, e. g. metabolic diseases, it seems certain that the number of targeted diseases will increase steadily in future. Taking into account the basic requirements described in this article, these will either be part of the extended neonatal screening or as an independent screening part of the secondary prevention in Germany. The article should provide an overview of the basics of established neonatal screening and provide insights into the prerequisites for the introduction of new target diseases into the newborn screening program in Germany.
Hintergrund
Das etablierte Neugeborenen-Screening auf angeborene Störungen des Stoffwechsels, des Hormon- und Immunsystems kann derzeit als eine der effektivsten Maßnahmen der Sekundärprävention angesehen werden. Ziel dieser genetischen Reihenuntersuchung auf Populationsbasis ist die frühzeitige Diagnosestellung und Therapieeinleitung bei möglichst allen von einer der Zielkrankheiten betroffenen Neugeborenen in Deutschland.
Auf Basis der Evaluation eines Modellprojektes in Bayern (1999–2001) [1] bewertete der Gemeinsame Bundesausschuss (G-BA) im Jahr 2004 zehn der mit Tandem-Massenspektrometrie (MS/MS) detektierbaren Stoffwechselkrankheiten als screeningwürdig. Diese wurden als Zielkrankheiten des sog. „Erweiterten Neugeborenen-Screenings“ (ENS) zusammen mit Biotinidasemangel, Galaktosämie und zwei endokrinologischen Erkrankungen in die Kinder-Richtlinie des G-BA und damit in den Leistungskatalog der gesetzlichen Krankenkassen aufgenommen [2]. Im September 2016 wurde die Kinder-Richtlinie mit Regelungen für das Screening auf Mukoviszidose (Cystische Fibrose, CF) ergänzt. Im März 2018 wurde die Tyrosinämie Typ I, eine sehr seltene ebenfalls mit MS/MS detektierbare Stoffwechselkrankheit, als 15. und im August 2019 Schwere kombinierte Immundefekte (SCID) als 16. Zielkrankheit dem ENS hinzugefügt (Tabelle 1). Bei letzterem handelt es sich im eigentlichen Sinne basierend auf der TREC-Bestimmung um ein Screening auf schwere T-Zell-Defekte. TREC sind kleine ringförmige DNA-Fragmente, die bei der Biosynthese des T-Zell-Rezeptors als Abfallprodukte entstehen und deren Anzahl im Blut mit der Zahl frisch entstehender naiver T-Zellen korreliert.
Die Aufnahme weiterer Zielkrankheiten, wie der 5q-assoziierte spinale Muskelatrophie (SMA) und der Sichelzellkrankheit, wird derzeit im G-BA beraten.
Zielkrankheiten des Neugeborenen-Screenings nach Kinder-Richtlinie (Stand 05/2019).
| Zielkrankheit | Prävalenz* |
| Hypothyreose | 1: 3.000 |
| Adrenogenitales Syndrom (AGS) | 1: 15.000 |
| Biotinidasemangel | 1: 26.000 |
| Galaktosämie (klassisch) | 1: 75.000 |
| Phenylketonurie (PKU) und Hyperphenylalaninämie (HPA) | 1: 5.000 |
| Ahornsirupkrankheit (MSUD) | 1: 170.000 |
| Medium-Chain-Acyl-CoA-Dehydrogenase-Mangel (MCAD-Mangel) | 1: 10.000 |
| Long-Chain-3-OH-Acyl-CoA-Dehydrogenase-Mangel (LCHAD-Mangel) | 1: 150.000 |
| Very-Long-Chain-Acyl-CoA-Dehydrogenase-Mangel (VLCAD-Mangel) | 1: 80.000 |
| Carnitinzyklusdefekte | 1: 600.000 |
| Glutaracidurie Typ I (GA I) | 1: 130.000 |
| Isovalerianacidämie (IVA) | 1: 90.000 |
| Tyrosinämie Typ I | 1: 135.000 |
| SCID | 1: 32.500** |
| Mukoviszidose (Cystische Fibrose, CF) | 1: 4.000–5.000 |
| Gesamt | 1: 1.000 |
* Größenordnung aus Screeningdaten Deutschland [3];
**geschätzte Prävalenz nach Literatur.
Grundlagen des Neugeborenen-Screenings auf angeborene Störungen des Stoffwechsels, des Hormon- und Immunsystem in Deutschland
Frühe Erkennung
Oberstes Ziel des ENS und des Screenings auf Mucoviszidose ist die frühestmögliche Diagnosestellung bei betroffenen Kindern. Nur durch eine frühzeitige Behandlung können in den ersten Lebenstagen auftretende, lebensbedrohliche Stoffwechsel- bzw. Elektrolytkrisen verhindert werden. So wurden z. B. bereits im Alter von einer Woche bei Neugeborenen mit Adrenogenitalem Syndrom (AGS) Elektrolytentgleisungen beobachtet, die auf Grund des zu diesem Zeitpunkt bereits vorliegenden Screeningbefundes behandelt werden konnten, bevor sie klinisch relevant wurden [4]. Darüber hinaus erleichtert die katabole Stoffwechsellage in den ersten zwei bis drei Lebenstagen die Detektion von β-Oxidationsstörungen der Fettsäuren und von Organoazidopathien. Ist dieser Zeitpunkt überschritten, so besteht bei vollständig kompensierter Stoffwechsellage die Gefahr falsch negativer Befunde [5]. Daher soll die Blutprobe für das Screening nach Möglichkeit zwischen 36 und 48 (bis zu 72) Lebensstunden abgenommen werden. Wurde das Screening bereits innerhalb der ersten 36 Lebensstunden durchgeführt, so muss den Eltern im Rahmen der U2 eine erneute Probenentnahme angeboten und damit das Screening wiederholt werden [6]. Wurde das Erstscreening bei Frühgeborenen vor 32 Schwangerschaftswochen (SSW) abgenommen, so soll es mit 32 SSW, jedoch frühestens 7 Tage nach dem Erst-Screening wiederholt werden.
Durchführung
Das Blut wird in der Regel aus der Ferse oder der Vene entnommen und auf eine Filterpapierkarte getropft, Nabelschnur- oder EDTA-Blut sowie Blut aus venösen Zugängen ist wegen gehäuft falsch negativer Befunde ungeeignet. Die Testkarte besteht aus einem Papierteil mit Beschriftungsfeldern, die vollständig ausgefüllt werden müssen und einem Filterpapieranteil für das Blut (Abb. 1). Das Blut wird getrocknet und an eines der elf Screeninglaboratorien [7] in Deutschland geschickt. Die Voraussetzung für die Zulassung als Screeninglabor sind in den §§ 23–26 und §§ 38–40 der Kinder-Richtlinie festgelegt. Das Screeninglabor muss über eine Akkreditierung für medizinische Laborleistungen verfügen. Der Laborarzt muss die Erbringung von 20.000 Tandem-Massenspektrometrien für das Jahr, welches dem vorgesehenen Tag der Genehmigung vorausgeht, oder – die regelmäßige Erbringung von Tandem-Massenspektrometrien über die letzten zwei Jahre nachweisen [2]. Weiterhin ist eine Mindestzahl von 50.000 untersuchten Erstscreeningproben innerhalb eines Jahres und in einem Labor Voraussetzung für die Teilnahme am Screening.
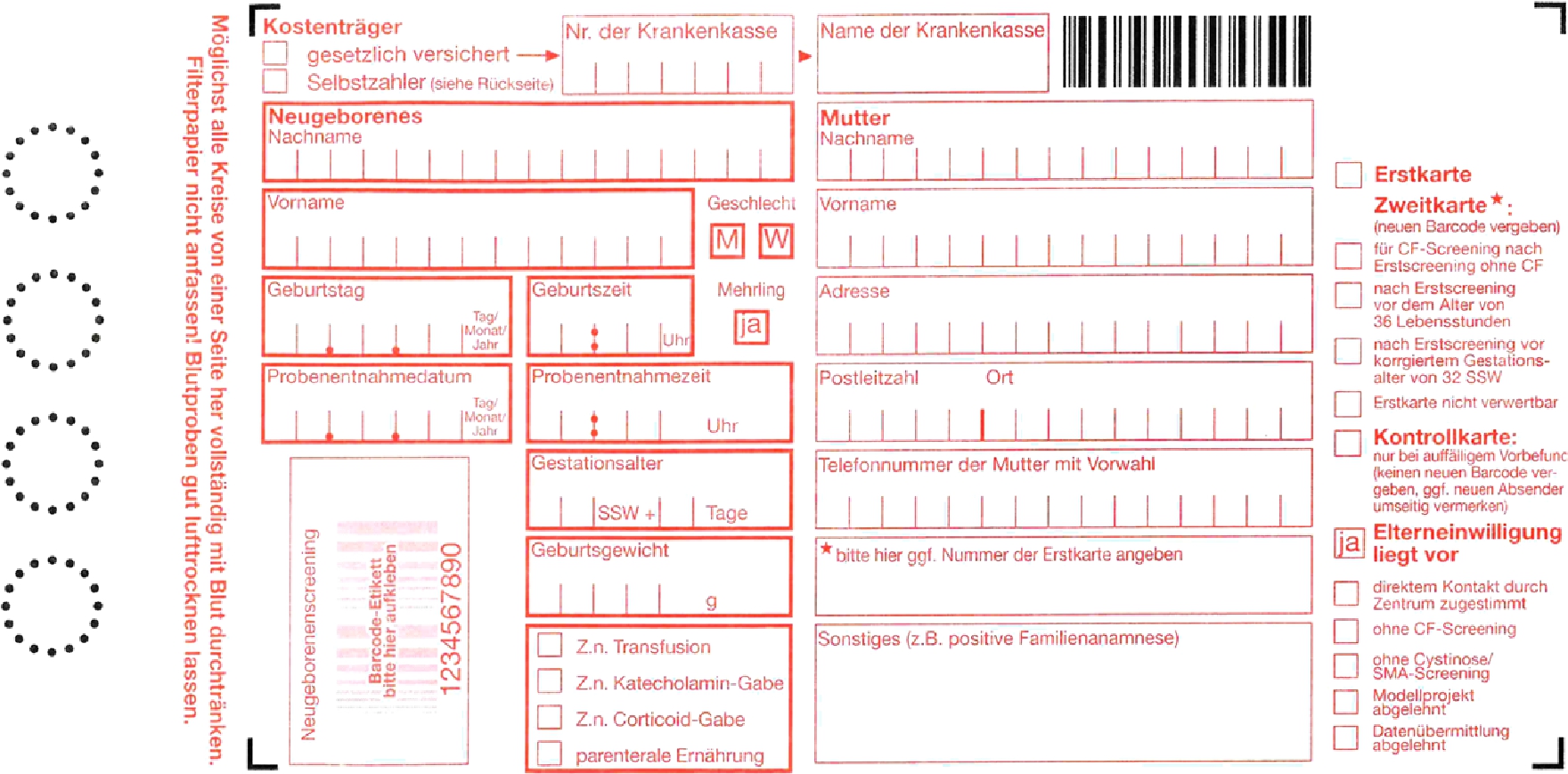
Beispiel für eine Testkarte.
Verantwortung für die Durchführung des Neugeborenen-Screening
Die Effektivität einer populationsbezogenen Reihenuntersuchung hängt unter anderem davon ab, dass möglichst viele Mitglieder dieser Population untersucht werden. Vor diesem Hintergrund legt die Kinder-Richtlinie klare Verantwortlichkeiten fest. So liegt die Verantwortung für die Durchführung des Screenings beim „Leistungserbringer, der die Geburt des Kindes verantwortlich geleitet hat“. Das sind im Normalfall primär die Fachärztin oder der Facharzt für Gynäkologie oder aber die Hebamme, ggf. geht sie auch auf die Fachärztin oder den Facharzt für Neonatologie über. Im Rahmen der U2-Früherkennungsuntersuchung muss sich die durchführende ärztliche Person vergewissern, dass die Entnahme der Blutprobe für das Neugeborenen-Screening im gelben Untersuchungsheft des Kindes dokumentiert wurde. Dies ist in der Regel an einem Barcodeaufkleber mit dem Namen des Screeninglaboratoriums und der Untersuchungsnummer ersichtlich. Ist das Screening nicht dokumentiert, so soll es bei der U2-Untersuchung des Kindes nachgeholt werden.
Regelungsrahmen: Kinder-Richtlinie und Gendiagnostikgesetz
Die praktische Durchführung des Neugeborenen-Screenings unterliegt den Regelungen der Kinder-Richtlinie des G-BA [2]. In einer S2k-Leitlinie der AWMF ist der gesamte Screeningprozess incl. der bei positivem Screeningbefund erforderlichen Maßnahmen detailliert beschrieben [8]. Da die meisten Zielkrankheiten des ENS ebenso wie CF genetisch bedingt sind, unterliegt diese Untersuchung als genetische Reihenuntersuchungen dem Gendiagnostikgesetz (GenDG; § 3 Nr. 9 und § 16 GenDG) [9]. Es handelt sich dabei um genetische Untersuchungen zu medizinischen Zwecken, die systematisch allen Neugeborenen angeboten werden, ohne dass notwendigerweise ein Hinweis auf die genetischen Eigenschaften, deren Vorhandensein mit der Untersuchung geklärt werden soll, besteht. Grundsätzlich gilt auch für genetische Reihenuntersuchungen der Arztvorbehalt nach § 7 Abs. 1 GenDG, nach dem die Aufklärung über eine genetische Untersuchung durch eine für die Untersuchung verantwortliche ärztliche Person erfolgen muss.
Aufklärung vor dem Neugeborenen-Screening
Genetische Reihenuntersuchungen erfordern eine vorherige mündliche ärztliche Aufklärung. Bei den zur Drucklegung dieses Artikels bestehenden genetischen Reihenuntersuchungen (Erweitertes Neugeborenen-Screening und Screening auf Mukoviszidose) in Deutschland handelt es sich um diagnostische genetische Reihenuntersuchungen im Sinne des GenDG. Daher gelten die Qualifikationsanforderungen für diagnostische genetische Untersuchungen, d. h. der einfache Arztvorbehalt. Eine besondere fachärztliche Qualifikation für die Durchführung diagnostischer genetischer Untersuchungen und damit verbundener Aufklärungen ist nicht erforderlich. Die Kinder-Richtlinie des G-BA sieht vor, dass die Eltern des Neugeborenen vor der Durchführung des Screenings eingehend und mit Unterstützung eines vorgegebenen Informationsblattes durch die verantwortliche ärztliche Person aufzuklären sind. Dieses Informationsblatt enthält alle Inhalte, über die die Eltern aufgeklärt werden müssen und wird von den Screeninglaboratorien zur Verfügung gestellt. Zudem regelt die Kinder-Richtlinie in den §§ 16 und 19 besondere Befugnisse der Hebammen und Entbindungspfleger (Ausnahmeregelungen, um ggf. gefährliche Verzögerungen zu vermeiden). Auf diese kann im Rahmen dieses Artikels nicht näher eingegangen werden. Generell kann die zur Durchführung des Screenings erforderliche Blutentnahme nach allgemeinem Arztrecht immer an die Hebamme bzw. das Pflegepersonal delegiert werden.
Sonderfall Mukoviszidose
Die oben erwähnten Ausnahmeregelungen für Nicht-Ärzte gelten nicht für das Screening auf Mukoviszidose (CF), da hier für das Kind keine Gefahr besteht, wenn das Screening erst zwischen dem 3. und 14. Lebenstag im Rahmen der U2-Früherkennungsuntersuchung erfolgt. Um dem Neugeborenen in diesen Fällen eine zweite Blutabnahme zu ersparen, kann die ärztliche Person die Eltern über das CF-Screening z. B. im Rahmen der U2-Untersuchung (erneut) aufklären, die schriftliche Einwilligung einholen und diese an das Screeninglabor, welches das erweiterte Neugeborenen-Screening vorgenommen hat, senden. Das Screeninglabor kann dann in einem Zeitraum von bis zu vier Wochen nach initialer Blutentnahme die nachgeforderte Untersuchung auf CF aus der vorliegenden Filterkarte nachholen.
Dokumentation der Einwilligung bzw. des Screenings
In den Aufklärungsmaterialien sind die Einwilligungserklärungen enthalten. Diese verbleiben in der Patientenakte. Das Vorliegen der Einwilligung zur Untersuchung ist für das Screeninglabor auf der Filterpapierkarte ersichtlich. Das Screening wird zudem im gelben Heft dokumentiert, getrennt für ENS- und CF-Screening.
Befundmitteilung
Unauffälliges Ergebnis
Unauffällige Ergebnisse werden dem Einsender der Blutprobe schriftlich mitgeteilt. Die Eltern erhalten ein unauffälliges Ergebnis nur auf Rückfrage vom Einsender.
Verdacht auf eine Hormon- oder Stoffwechselstörung
Auffälliges Ergebnis (Vorgehen und zweite Testkarte)
Bei einem eindeutig pathologischen Ergebnis im Stoffwechsel- und Hormonscreening ist die Wahrscheinlichkeit für das Vorliegen einer Erkrankung hoch und der Befund muss rasch durch eine Konfirmationsdiagnostik abgeklärt werden.
Es kann aber auch ein grenzwertiges oder, bedingt durch die normale biologische Variabilität der untersuchten Parameter, nur vorübergehend auffälliges Ergebnis vorliegen, bei dem eine Erkrankung nicht ausgeschlossen werden kann. In diesen Fällen wird zunächst ein Kontrollscreening mittels einer zweiten, neuen Testkarte zur Klärung des auffälligen Ergebnisses angefordert [8].
Wichtig ist zu wissen, dass ein positives (auffälliges) Screeningergebnis, unabhängig von der eingesetzten Methode, per se noch keine Diagnosestellung erlaubt, sondern lediglich einen Krankheitsverdacht liefert.
Der PPV des gesamten ENS liegt bei ca. 20 %, je nach Krankheit zwischen 3 und 71 %, bei hoch pathologischen Werten deutlich höher.
Information der Eltern
In beiden Fällen (auffälliges und grenzwertiges Ergebnis) soll die verantwortliche (einsendende) ärztliche Person, kein Pflegepersonal, dann umgehend die Eltern informieren. Dabei sollte durch eine kompetente Information unnötige Beunruhigung vermieden, gleichzeitig aber auf eine rasche Kontrolluntersuchung hingewirkt werden. Der Befund enthält Empfehlungen für die zu ergreifenden Maßnahmen. Dies ist entweder möglichst zeitnah eine Blutabnahme für das erforderliche Kontrollscreening oder bei eindeutig pathologischem Befund die Vorstellung in einem pädiatrischen Stoffwechsel- bzw. Endokrinologie-Zentrum [10]. Generell gilt, dass das Zeitfenster zwischen Mitteilung des positiven Screening-Befundes und der weiteren Abklärung möglichst kurz sein sollte, um die Beunruhigung der Eltern möglichst gering zu halten.
Tracking (Nachverfolgung)
Zum Zeitpunkt der Ergebnismitteilung sind die Mütter oft schon entlassen, sodass die Eltern häufig sehr schwer telefonisch zu erreichen sind. In solchen Fällen kommt es immer wieder vor, dass die Information der Eltern vergessen oder aufgeschoben wird. Aus diesen Gründen sind in einigen Bundesländern sog. Trackingzentren eingebunden, die sicherstellen, dass die Eltern erreicht, Kontrolluntersuchungen auch wirklich durchgeführt und auffällige Befunde abgeklärt werden. Dies ist ein wichtiger Bestandteil der Qualitätssicherung des Screenings und sollte überall ein fester Baustein im Screening-Programm sein.
Konfirmationsdiagnostik
Bei allen Zielkrankheiten des ENS handelt es sich um seltene Erkrankungen (rare diseases). Das bedeutet, die weiterführende Diagnostik (Konfirmationsdiagnostik) muss durch Spezialisten mit Erfahrung, in der Regel in entsprechenden Zentren erfolgen. Sie umfasst neben der klinischen Untersuchung meist eine weitergehende Labordiagnostik, ggf. inklusive Enzym- und Gendiagnostik [1], [2], [3], [11], [12], [13]. Für die Qualitätssicherung der Screeninganalytik ist eine Rückmeldung des Ergebnisses der Konfirmationsdiagnostik an das Screeninglabor unerlässlich. Nur so können die Grenzwerte optimiert werden, um die Anzahl der falsch positiven Screeningbefunde möglichst gering zu halten (Spezifität) ohne betroffene Kinder zu übersehen (Sensitivität).
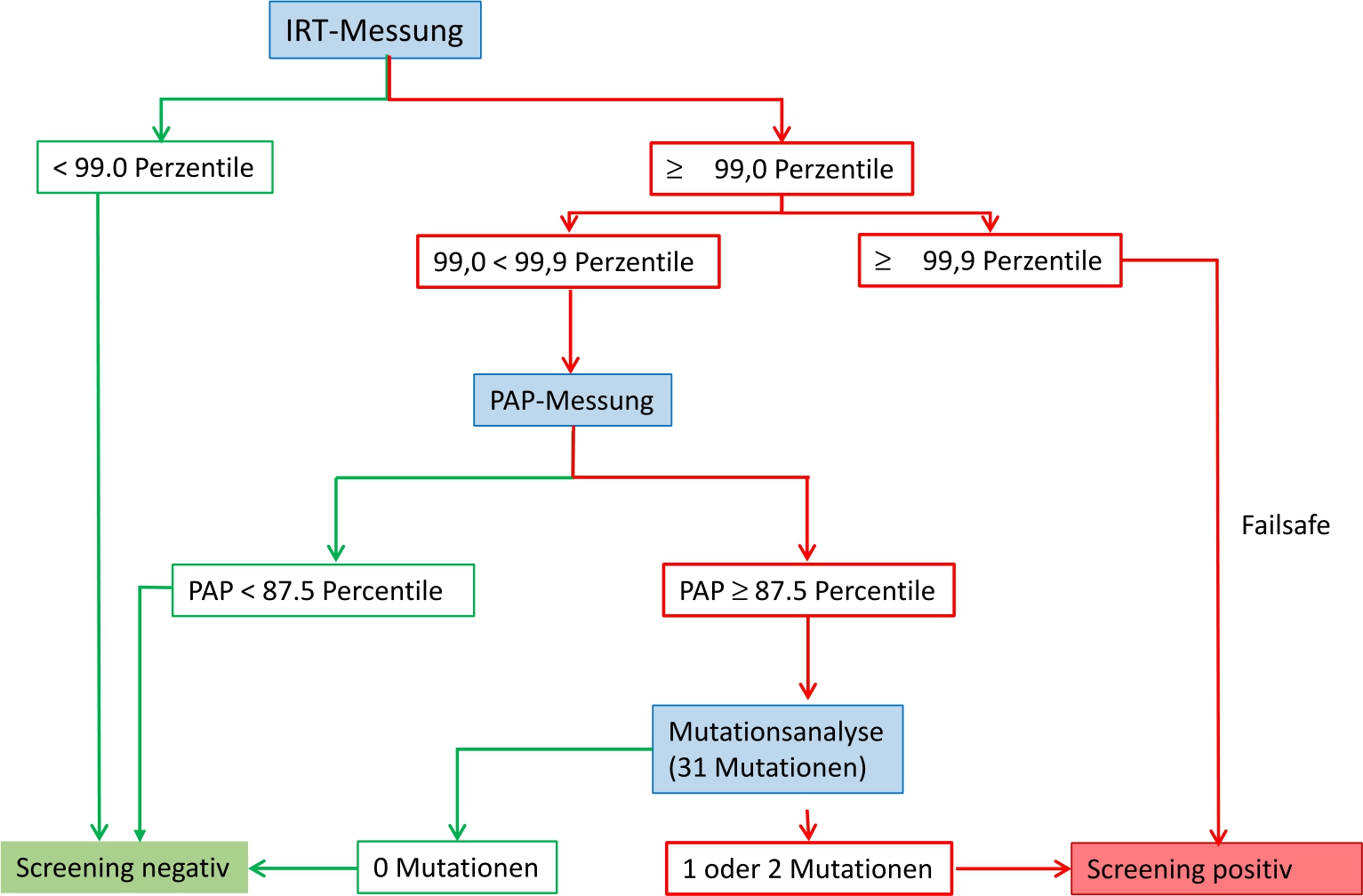
Algorithmus des CF-Screenings.
Screening am Beispiel der Mukoviszidose
Algorithmus
Das Screening auf Mukoviszidose (CF), die häufigste lebensverkürzende, autosomal-rezessive Erkrankung bei Neugeborenen in Deutschland, wird dreistufig als serielle Kombination von zwei biochemischen Tests zunächst auf immunreaktives Trypsin (IRT), ist dieses erhöht, auf Pankreatitis-assoziiertes Protein (PAP) durchgeführt. Ist auch der PAP-Wert erhöht so folgt in einer dritten molekulargenetischen Stufe die Suche nach den 31 in Deutschland häufigsten pathogenen Mutationen des Cystic Fibrosis Transmembran Regulator-Gens (CFTR-Gens) (Abb. 2) [8].
Das Screening wird bereits als auffällig (positiv) bewertet, wenn ein IRT-Wert oberhalb der 99,9. Perzentile liegt (sog. „Failsafe“) oder wenn in der dritten Stufe auf mindestens einem Allel eine der 31 untersuchten Mutationen des CFTR-Gens nachgewiesen wird. In allen anderen Konstellationen gilt das Screening als unauffällig (negativ). Dieser Screeningalgorithmus führt dazu, dass „Failsafe“ ca. 80 % der positiven Screeningbefunde bedingt. Das wiederum bedeutet, dass bei 80 % der Kinder mit positivem Screeningergebnis keine DNA-Analytik im Rahmen des Screenings durchgeführt wurde. Die Auswertung der Screeningdaten für 2017 zeigt, dass nur bei jedem vierten bis fünften Kind mit einem positiven Screeningbefund, beruhend auf Failsafe oder dem Ergebnis der Mutationsanalytik, letztendlich eine Mukoviszidose vorlag [14].
In seiner aktuellen Konstellation ist der Algorithmus bislang nicht wissenschaftlich evaluiert und publiziert. Eine Überprüfung der wissenschaftlichen Evidenz des gewählten Screeningverfahrens im Sinne der von der GEKO in ihrer Richtlinie geforderten “kontinuierlichen Evaluation der Struktur-, Prozess- und Ergebnisqualität” wird vom G-BA befürwortet und ist aus Sicht der GEKO unverzichtbar, um als qualitätssichernde Maßnahme eine hohe wissenschaftliche Aussagekraft der Testung zu gewährleisten und damit zugleich eine unnötige Beunruhigung von Eltern nicht erkrankter Kindern auf ein möglichst geringes Maß zu reduzieren [15].
Ergebnismitteilung CF-Screening
Das Ergebnis des CF-Screenings wird dem Einsender nur als positiver oder negativer Befund innerhalb von 14 Tagen mitgeteilt. Einzelheiten zum Ergebnis der einzelnen Komponenten des Algorithmus werden im Rahmen des Screenings nicht mitgeteilt. Der Schweißtest als weiterführende Konfirmationsdiagnostik kann erst ab 14 Lebenstagen sowie bei Kindern mit einem Körpergewicht über 3000 g und einem korrigierten Alter von mindestens 36 Schwangerschaftswochen zuverlässig durchgeführt werden [16]. Daher sollten hier die Eltern über einen positiven Screening-Befund möglichst erst dann informiert werden, wenn zeitnah (am besten am nächsten Tag) ein Schweißtest durchgeführt werden kann. Dieser sollte unbedingt in einer auf die Diagnose und Behandlung der Mukoviszidose spezialisierten Einrichtung (nach Möglichkeit ein von Mukoviszidose e. V. Bundesverband Cystische Fibrose zertifiziertes Zentrum) durchgeführt werden.
Bei Vorliegen eines abklärungsbedürftigen Schweißtests oder einer anderen abklärungsbedürftigen Konfirmationsdiagnostik können auf Basis entsprechender elterlicher Einwilligung, die im Rahmen der Konfirmationsdiagnostik eingeholt wird, die Ergebnisse der eventuell durchgeführten DNA-Analysen direkt beim Screening-Labor von der weiterbehandelnden ärztlichen Person angefordert werden [17]. Bei unauffälligem Schweißtest werden die Ergebnisse der Mutationsanalytik aus dem Neugeborenen-Screening nicht mitgeteilt.
Einführung einer neuen genetischen Reihenuntersuchung oder Zielkrankheit bei Neugeborenen
Vor dem Hintergrund verbesserter diagnostisch-analytischer Möglichkeiten und neuer therapeutischer Optionen bei schweren angeborenen Erkrankungen werden neue genetische Reihenuntersuchungen bei Neugeborenen für zunehmend mehr Zielkrankheiten als populationsbasiertes Screening von Ärzten, Patientengruppen oder Politikern rasch gefordert. Dabei ist jedoch das Verhältnis von Nutzen und Schaden für die Betroffenen nicht immer evident und mögliche Belastungen für Gesunde werden oft unterschätzt. Ob das Screening auf die etablierten und neue Zielkrankheiten medizinisch und ethisch sinnvoll sowie effektiv umsetzbar ist, muss an Hand der vorliegenden Evidenz sowie ethischer Kriterien geklärt und kontinuierlich evaluiert und überprüft werden. Hierbei muss immer berücksichtigt werden, dass sich Screeningprogramme an eine größtenteils gesunde Bevölkerungsgruppe richten.
Ein populationsbasiertes Screening sollte immer in Form eines Programmes eingeführt werden, in dem die Abläufe und Verantwortlichkeiten von der Aufklärung bis zur Therapieeinleitung klar geregelt sind sowie kontinuierlich überprüft und in der Folge optimiert werden. Nur so kann der Schaden für die Gesunden minimiert werden und die Betroffenen können durch eine kompetente Diagnostik und Therapie vom Screening wirklich profitieren. Der Schaden, der durch ein Screeningverfahren entstehen kann, betrifft auf Grund von falsch positiven Befunden zum einen die Gesunden, zum anderen Betroffene mit mildem Phänotyp der Erkrankung, die vielleicht nie oder zu einem viel späteren Zeitpunkt erste Symptome entwickelt hätten. Hier werden die Familien in einer ausgesprochen vulnerablen Lebensphase (Wochenbett) unnötigerweise sehr beunruhigt. Bei milden oder spätmanifestierenden Verlaufsformen können sich die Befunde z. B. auch auf Versicherungsabschlüsse der Betroffenen auswirken. Bei Betroffenen mit falsch-negativem (unauffälligem) Screeningbefund werden im Verlauf auftretende Symptome nicht selten falsch zugeordnet. Grundsätzlich wird eine etwas niedrigere Sensitivität bei populationsbezogenen Reihenuntersuchungen im Gegensatz zur individualmedizinischen Diagnostik zu Gunsten einer hohen Spezifität in Kauf genommen, um die Belastung von Gesunden durch falsch positive Befunde möglichst gering zu halten.
GEKO Stellungnahme, GEKO-Richtlinie
Mit einer genetischen Reihenuntersuchung darf nur begonnen werden, wenn die GEKO die Untersuchung in einer schriftlichen Stellungnahme bewertet hat (§ 16 Abs. 2 GenDG). Die Bewertung einer neuen Untersuchung ist einschränkend nur für solche genetischen Reihenuntersuchungen vorgeschrieben, die nach Inkrafttreten des GenDG eingeführt und damit dann erst begonnen wurden. Wenn eingeführte genetische Reihenuntersuchungen um eine Zielkrankheit ergänzt werden sollen, bedarf dies vorab auch einer Stellungnahme der GEKO nach § 16 Abs. 2 GenDG. Kriterien, anhand derer die GEKO eine Bewertung vornimmt und ihre Stellungnahmen verfasst, sind in der „Richtlinie für die Anforderungen an die Durchführung genetischer Reihenuntersuchungen gemäß § 23 Abs. 2 Nr. 6 GenDG“ veröffentlicht [18]. Diese gründet auf den Anforderungen des GenDG sowie den bereits 1968 aufgestellten Screeningkriterien von Wilson und Jungner (Tab. 2) [19], die mittlerweile wiederholt überarbeitet wurden [20].
Screeningkriterien.
| Durch das Auftreten der Krankheit liegt ein relevantes Gesundheitsproblem für die betroffene Person oder die Gesellschaft vor. |
| Der natürliche Verlauf der Krankheit ist bekannt. |
| Die Krankheit kann durch klinische Symptome zum Zeitpunkt des Screenings in der Regel nicht erkannt werden. |
| Die Krankheit ist behandelbar und der Behandlungsbeginn vor Auftreten von Symptomen verhindert die Folgen der Krankheit oder vermindert diese erheblich. |
| Ein geeignetes und für die Bevölkerung annehmbares Testverfahren steht zur Früherkennung zur Verfügung. |
| Die Risiko-/Nutzen-Relation des Screenings liegt auf der Seite des Nutzens. Bei der Bewertung des Risikos müssen physische, psychische und soziale Belastungen berücksichtigt werden. |
| Ein Screening-Programm mit klar definierten Verantwortlichkeiten und Abläufen von der Screening-Untersuchung bis zum Therapiebeginn steht zur Verfügung. |
Fazit für die Praxis
Bei einem populationsbasierten Screening ist eine möglichst vollständige Teilnahme anzustreben.
Das erweiterte Neugeborenen-Screening soll am 2. oder 3. Lebenstag durchgeführt werden.
In der Regel ist eine ärztliche Aufklärung erforderlich.
Aus dem Screening ergibt sich immer nur eine Verdachtsdiagnose, die weiter abgeklärt werden muss.
Das Ergebnis der Konfirmationsdiagnostik soll aus Gründen der Qualitätssicherung dem Screeninglabor mitgeteilt werden.
Vor Einführung eines neuen Screenings sind die vorliegende Evidenz sowie die ethischen Voraussetzungen kritisch zu prüfen.
Literatur
[1] Roscher A, Fingerhut R, Liebl B, Olgemöller B. Erweiterung des Neugeborenenscreenings durch Tandemmassenspektrometrie. Monatsschr Kinderheilkd. 2001;149:1297–303.10.1007/s001120170015Suche in Google Scholar
[2] G-BA. Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Kinder-Richtlinien: Anpassung des erweiterten Neugeborenen-Screenings an das Gendiagnostikgesetz (GenDG). BAnz AT 15.03.2018 B2; 2017.Suche in Google Scholar
[3] http://www.screening-dgns.de/reports.php. p Zugegriffen: 29. Mai 2019.Suche in Google Scholar
[4] Odenwald B, HG D, Bonfig W, Schmidt H, Fingerhut R, Wildner M, Nennstiel-Ratzel U. Classic Congenital Adrenal Hyperplasia due to 21-Hydroxylase-Deficiency: 13 Years of Neonatal Screening and Follow-up in Bavaria. Klin Padiatr. 2015;227(5):278–83.10.1055/s-0035-1554639Suche in Google Scholar PubMed
[5] Spiekerkötter U. Angeborene Störungen der Fettsäurenoxidation. Pädiat Prax. 2009;73:655–69.Suche in Google Scholar
[6] Nennstiel-Ratzel U, Lüders A, Odenwald B, Mohnike K, Liebl B. Neugeborenenscreening auf angeborene Stoffwechsel- und Hormonstörungen in Deutschland. Gynakol Prax. 2014;38:51–8.Suche in Google Scholar
[7] http://www.screening-dgns.de/screeninglabors.php. Zugegriffen: 29. Mai 2019.Suche in Google Scholar
[8] https://www.awmf.org/uploads/tx_szleitlinien/024-012l_S2k_Neugeborenenscreening_2019-04.pdf. Zugegriffen: 29. Mai 2019.Suche in Google Scholar
[9] Bundesregierung. Gesetz über genetische Untersuchungen bei Menschen (Gendiagnostikgesetz – GenDG). BGBl. 2009;I:50.Suche in Google Scholar
[10] Nennstiel-Ratzel U. Neugeborenenscreening auf Stoffwechsel- und Hormonstörungen sowie Mukoviszidose. Geburtshilfe Frauenheilkd. 2017;77:1147–50.10.1055/s-0043-119162Suche in Google Scholar
[11] AWMF Leitlinie Konfirmationsdiagnostik bei Verdacht auf angeborene Stoffwechselkrankheiten aus dem Neugeborenenscreening. Registernummer 027–021, Stand: 01.03.2010, gültig bis 31.03.2015. Aktuell in Überarbeitung.Suche in Google Scholar
[12] AWMF Leitlinie Adrenogenitales Syndrom. Registernummer 027–047, Stand: 01.01.2010, gültig bis 31.01.2015. Aktuell zur Überarbeitung neu angemeldet unter AWMF-Reg. Nr. 174–003.Suche in Google Scholar
[13] AWMF Leitlinie Diagnostik, Therapie und Verlaufskontrolle der angeborenen primären Hypothyreose. Registernummer 027–017, Stand: 01.02.2011, gültig bis 31.01.2016. Aktuell in Überarbeitung.Suche in Google Scholar
[14] http://www.screening-dgns.de/reports.php (muss aktualisiert werden DGNS Report 2017 wird demnächst online gestellt).Suche in Google Scholar
[15] https://www.rki.de/DE/Content/Kommissionen/GendiagnostikKommission/Stellungnahmen/Stellungnahme_Mukoviszidose-Screening.html. Zugegriffen: 29. Mai 2019.Suche in Google Scholar
[16] Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). S2-Konsensus-Leitlinie „Diagnose der Mukoviszidose“ (AWMF-Registernummer 026–023). 2013. http://www.awmf.org/uploads/tx_szleitlinien/026-023lS_2k_Diagnose_der_Mukoviszidose_2013-07.pdf.Suche in Google Scholar
[17] Gendiagnostik-Kommission (GEKO). 10. Mitteilung über die Heranziehung von Ergebnissen der DNA-Analysen aus genetischen Reihenuntersuchungen auf Mukoviszidose bei Neugeborenen; 2015. http://www.rki.de/DE/Content/Kommissionen/GendiagnostikKommission/Mitteilungen/GEKO_Mitteilungen_10.html.Suche in Google Scholar
[18] https://www.rki.de/DE/Content/Kommissionen/GendiagnostikKommission/Richtlinien/RL_Reihenuntersuchung.pdf?__blob=publicationFile.Suche in Google Scholar
[19] Wilson JM. Principles of screening for disease. Proc R Soc Med. 1971;64:1255–6.10.1177/003591577106401238Suche in Google Scholar
[20] Andermann A, Blancquaert I, Beauchamp S et al. Guiding policy decisions for genetic screening: developing a systematic and transparent approach. Public Health Gen. 2011;14:9–16.10.1159/000272898Suche in Google Scholar PubMed
© 2020 Nennstiel and Tönnies, publiziert von De Gruyter
This work is licensed under the Creative Commons Attribution 4.0 International License.
Artikel in diesem Heft
- Frontmatter
- Editorial
- Altbewährt – und dennoch (fast) ganz neu
- MAIN TOPIC: GENOMICS AND EPIGENOMICS OF PSYCHIATRIC DISORDERS OF PSYCHIATRIC DISORDERS
- Out of the lab and into the clinic: steps to a pragmatic new era in psychiatric genetics
- Insights into the genomics of affective disorders
- Update on the genetic architecture of schizophrenia
- Genetic and epigenetic findings in anorexia nervosa
- Clinical genetic testing and counselling in autism spectrum disorder
- Polygenic scores for psychiatric disease: from research tool to clinical application
- Brain imaging genomics: influences of genomic variability on the structure and function of the human brain
- A Review of epigenetics in psychiatry: focus on environmental risk factors
- BERICHTE AUS DER HUMANGENETIK
- Aus Diagnostik und Beratung
- Grundlagen und aktueller Stand des Neugeborenen-Screenings auf angeborene Störungen des Stoffwechsels, des Hormon- und Immunsystems in Deutschland
- Rechtsfragen
- 10 Jahre Gendiagnostikgesetz – wie kann die Vernichtungspflicht für Ergebnisse genetischer Analysen und Untersuchungen praktisch umgesetzt werden?
- Personalien
- Nachruf Gebhard Flatz (1925–2019)
- Eberhard Schwinger zum 80. Geburtstag
- GfH-Verbandsmitteilungen
- Berichte der GfH-Kommissionen, -Arbeitskreise und -Delegierten
- BVDH-Verbandsmitteilungen
- Impressionen der BVDH-Herbsttagung 2019 in Köln
- Aktuelle Nachrichten
- Aktuelle Nachrichten
Artikel in diesem Heft
- Frontmatter
- Editorial
- Altbewährt – und dennoch (fast) ganz neu
- MAIN TOPIC: GENOMICS AND EPIGENOMICS OF PSYCHIATRIC DISORDERS OF PSYCHIATRIC DISORDERS
- Out of the lab and into the clinic: steps to a pragmatic new era in psychiatric genetics
- Insights into the genomics of affective disorders
- Update on the genetic architecture of schizophrenia
- Genetic and epigenetic findings in anorexia nervosa
- Clinical genetic testing and counselling in autism spectrum disorder
- Polygenic scores for psychiatric disease: from research tool to clinical application
- Brain imaging genomics: influences of genomic variability on the structure and function of the human brain
- A Review of epigenetics in psychiatry: focus on environmental risk factors
- BERICHTE AUS DER HUMANGENETIK
- Aus Diagnostik und Beratung
- Grundlagen und aktueller Stand des Neugeborenen-Screenings auf angeborene Störungen des Stoffwechsels, des Hormon- und Immunsystems in Deutschland
- Rechtsfragen
- 10 Jahre Gendiagnostikgesetz – wie kann die Vernichtungspflicht für Ergebnisse genetischer Analysen und Untersuchungen praktisch umgesetzt werden?
- Personalien
- Nachruf Gebhard Flatz (1925–2019)
- Eberhard Schwinger zum 80. Geburtstag
- GfH-Verbandsmitteilungen
- Berichte der GfH-Kommissionen, -Arbeitskreise und -Delegierten
- BVDH-Verbandsmitteilungen
- Impressionen der BVDH-Herbsttagung 2019 in Köln
- Aktuelle Nachrichten
- Aktuelle Nachrichten

