Referenzintervalle für eisenabhängige Blutparameter bei Kindern und Jugendlichen: Ergebnisse einer populationsgestützten Kohortenstudie (LIFE Child)
-
Kristin Rieger
Zusammenfassung
Einleitung: Es werden pädiatrische Referenzintervalle zu eisenabhängigen Parametern kontinuierlich über das Alter unter Anwendung des, in der Laboratoriumsmedizin noch wenig bekannten, R-Pakets GAMLSS aus einer hoch standardisierten Probenpopulation ermittelt.
Methoden: 2778 Blutproben von LIFE Child-Probanden im Alter von 2,5 bis 19 Jahren wurden mittels Sysmex XN-9000 für Hämoglobin und Retikulozyten, sowie mittels Roche cobas 8000 für Transferrin und Ferritin analysiert. Die Schätzung der Referenzintervalle erfolgte durch wiederholte Modellberechnungen unter Anwendung der LMS-Methode nach Cole mit spezifisch gewichteten Teilstichproben.
Ergebnisse: Es wurden kontinuierliche und geschlechtsspezifische Referenzintervalle sowie geglättete Perzentilenkurven für Hämoglobin, Ferritin, Retikulozyten und Transferrin erstellt. Dabei konnten aufgrund der wiederholten Modellberechnungen Einzelkurven und durch Mittelung zusammengefasste Perzentilenkurven erstellt werden. Die Einzelkurven gaben einen Überblick über potentielle Schwankungen der einzelnen Parameterverläufe. Die gemittelten Kurven ermöglichten eine stabile Kurvenverlaufsbeurteilung der eisenabhängigen Parameter im Kindes- und Jugendalter.
Schlussfolgerungen: Hiermit stehen erstmals mit dem GAMLSS-R-Paket und für die hier verwendeten Gerätetechniken eruierte aktuelle alters- und geschlechtsspezifische Referenzintervalle zur Verfügung. Verglichen zu bisherigen Studien können frühere Ergebnisse vervollständigt und Diskrepanzen, abhängig vom unterschiedlichen methodischen Vorgehen, verdeutlicht werden. Relevante Erkenntnisse für die Diagnostik der Eisenmangelanämie, wie eine geschlechtsabhängige Beurteilung des Hämoglobins ab dem 11. Lebensjahr statt wie bisher ab 15 Jahren (nach WHO), werden dargestellt.
Abstract
Background: Pediatric reference intervals for iron-related parameters are determined continuously over time from a highly standardized sample collection by application of the R-package GAMLSS, which is little known in laboratory medicine.
Methods: Two thousand seven hundred and seventy-eight samples from LIFE Child-participants at the age of 2.5–19 years were analyzed on a Sysmex XN-9000 for hemoglobin and reticulocytes and on a Roche Cobas 8000 for transferrin and ferritin. Reference intervals were established by repeated model calculation by use of the LMS-method from Cole with specifically weighted subsamples.
Results: Continuous and gender-specific reference intervals as well as smoothed percentile curves were established for hemoglobin, ferritin, reticulocytes and transferrin. In the case of repeated model calculations, single curves and averaged percentile curves were shown. The single curves outlined potential variations of the different parameter trends. The averaged percentile curves submitted a stable assessment of curve trends over time for iron-related parameters in childhood and adolescence.
Conclusions: For the first time current age- and gender-specific reference intervals are available by application of the R-package GAMLSS and the laboratory techniques applied here. Compared to earlier studies, previous findings can be completed and discrepancies related to different methodical approaches, can be pointed out. Relevant findings for the diagnosis of iron deficiency anemia, such as gender-dependent assessment of hemoglobin starting at the age of 11 instead of 15 (according to WHO), are presented.
Einleitung
Eisen stellt mengenmäßig das häufigste essenzielle Spurenelement des Menschen dar und ist mit den von ihm abhängigen Enzymen an wichtigen Stoffwechselprozessen, wie Sauerstoffbindung und -verteilung über Hämoglobin und Myoglobin, Transmitterproduktion oder Zytokininduktion, beteiligt. Eine unzureichende Eisenversorgung kann vielfältige Ursachen haben und zeigt sich in einem Eisenmangel bis hin zu einer Eisenmangelanämie, welche die weltweit häufigste Form der Anämie darstellt [1]. Klinisch manifestiert sich diese bei Kindern im Gegensatz zu Erwachsenen früh, aufgrund des erhöhten Bedarfs während des Wachstums. Die Symptome sind weitreichend und können bis hin zu Einschränkungen der körperlichen, kognitiven, psychischen und motorischen Entwicklung reichen [2, 3]. Eine Eisenmangelanämie wird, entgegen veralteter Annahmen, nicht über eine Erniedrigung der Eisenkonzentrationen, sondern über eine Erniedrigung der Hämoglobin- und Ferritinkonzentrationen deutlich, welche die altersentsprechenden Mittelwerte um mehr als zwei Standardabweichungen unterschreiten [4]. Bereits eine Erniedrigung der Ferritin- und Erhöhung der Transferrinkonzentrationen bei normalem Hämoglobin weisen auf einen latenten Eisenmangel hin. Eine erniedrigte Retikulozyten-Zahl weist neben einer Hämoglobinerniedrigung auf einen manifesten Eisenmangel hin [5, 6].
Referenzintervalle dienen der klinischen Interpretation von Laborergebnissen und sind damit Basis für klinische Entscheidungen. Besonders in der Pädiatrie werden altersbezogene Referenzintervalle benötigt, um physische Entwicklung, Ernährung, Wachstum, Organreife, Hormon- und Immunantworten sowie Erkrankungen während spezifischer Altersabschnitte adäquat berücksichtigen zu können. Nachdem für eisenabhängige Parameter lange Zeit Referenzintervalle verwendet wurden, die entweder vor mehreren Jahrzehnten oder auf Grundlage hospitalisierter Probanden bestimmt wurden, nahmen in den letzten Jahren die Bemühungen um die Ermittlung aktueller Referenzintervalle zu [7, 8]. Dazu trugen bevölkerungsbezogene Daten für Kinder unterschiedlicher Altersklassen aus den USA (NHANES, 1994; AACC, 2007) [9–11], Irland (1997) [12], Kanada (CALIPER, 2009/10/12) [13–15], Deutschland (KiGGS, 2009 [16]; Zierk et al. [17]), Dänemark (2012) [18] und Schweden (2013) [19] bei. Referenzintervalle wurden für Hämoglobin in sechs, für Ferritin in vier, für Retikulozyten in zwei und für Transferrin in vier der acht benannten Studien angegeben. Weiterhin wurden Referenzintervalle für Hämoglobin und Ferritin bisher nur in den deutschen Studien kontinuierlich über das Alter, inklusive Referenzperzentilen, statt Alterskategorien bestimmt. Für Transferrin und Retikulozyten liegen einerseits noch keine kontinuierlichen Referenzintervalle vor. Andererseits gelten diese Parameter bislang generell als Parameter mit schlecht gesicherten Angaben zu Referenzintervallen, aufgrund von Standardisierungsdefiziten bei den Messverfahren, sowie fehlender oder schlecht gesicherter Datengrundlage speziell im Kindesalter [20]. Aufgrund der beschriebenen Lücken ist das Ziel der vorliegenden Arbeit für die Parameter Hämoglobin, Retikulozyten, Ferritin und Transferrin alters- und geschlechtsabhängige Referenzintervalle, inklusive Perzentilenkurven, zu ermitteln. Dies geschieht auf Grundlage einer großen Studienpopulation mittels aktueller hoch standardisierter laboranalytischer Methoden und unter Anwendung des bisher in der Laboratoriumsmedizin wenig bekannten R-Pakets GAMLSS (Generalized Additive Models for Location, Scale and Shape).
Material und Methoden
Studiendesign und -teilnehmer
Es wurden Daten von Teilnehmern der LIFE Child-Studie im Alter von 2,5 bis 19 Jahren im Raum Leipzig herangezogen. LIFE Child ist ein Teilprojekt des „Leipziger Forschungszentrums für Zivilisationserkrankungen“ der Universität Leipzig mit einem Längsschnitt-Querschnitt-Design. Die Studie wurde durch die zuständige Ethikkommission positiv bewertet (Reg. No. 264-10-19042010). Zu Beginn eines jeden Besuches erfolgte die Aufklärung der Probanden und ihrer Eltern durch einen Studienarzt sowie die Unterzeichnung einer Einwilligungserklärung als Voraussetzung zur Studienteilnahme. Die Daten der Probanden wurden pseudonymisiert, damit keine Rückschlüsse auf die Einzelpersonen gezogen werden konnten [21]. Die Teilnehmer entstammten keiner klinischen Kohorte, wodurch es sich um primär gesunde Kinder und Jugendliche handelte, die für die Referenzintervallberechnung herangezogen wurden. Für die Datenanalyse wurden nur Messzeitpunkte berücksichtigt, zu denen Messwerte für Hämoglobin, Ferritin, Retikulozyten und Transferrin vollständig vorlagen. Damit standen 2778 Messzeitpunkte von 1779 Probanden aus 1346 Familien zur Verfügung. In Abbildung 1 ist die Alters- und Geschlechtszusammensetzung der Stichprobe zum jeweils ersten Messzeitpunkt dargestellt. Bezüglich der Gewichtsverteilung wies die Mehrheit der Kinder (78%) ein normales Gewicht auf, während 7% untergewichtig, 7% übergewichtig und 8% der Kinder adipös waren. Der altersadjustierte BMI lag im Mittel bei 0,1 mit einem Minimalwert von –4,6 und Maximalwert von 4,8. Da sich die Altersadjustierung auf Referenzen nach Kromeyer-Hauschild bezieht [22], ist die leichte Mittelwerterhöhung auf die in den letzten Jahren zunehmende Tendenz in Richtung Übergewicht bei Kindern zurückzuführen. Da die Beeinflussung der Parameter Ferritin und Transferrin durch mögliche Infekte nicht ausgeschlossen werden konnte, wurden hierfür jeweils dieselben Berechnungen zusätzlich unter Ausschluss der Messzeitpunkte bei gleichzeitig vorliegender Erhöhung des CRP von größer gleich 5 mg/L (n=84) durchgeführt. Allgemein zeigte sich eine CRP-Erhöhung von größer gleich 2,8 bis 5,0 mg/L bei 5% und von größer gleich 5,0 mg/L bei 3% der Studienteilnehmer. Bei 92% der Teilnehmer lag der CRP-Wert innerhalb des Referenzintervalls. Weiterhin wurde bei 0,4% der Messzeitpunkte (n=10) eine medikamentöse Eisenaufnahme dokumentiert. Diese wurden aufgrund der geringen Anzahl nicht ausgeschlossen.
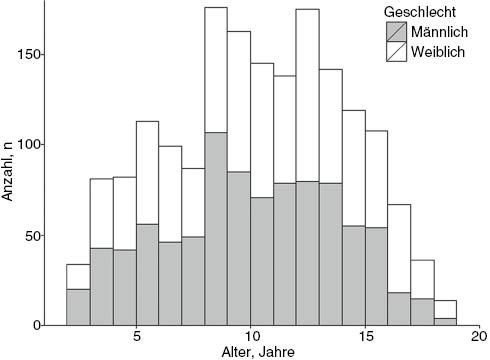
Histogramm zur Alters- und Geschlechtsverteilung der Referenzpopulation aus der LIFE Child Kohorte zum Erstbesuch (Gesamt: n=1779, Jungen: n=903, Mädchen: n=876).
Präanalytik und Analytik
Venöse Blutproben wurden zu Beginn eines Untersuchungstages in EDTA-Vollblut- und Serum-Monovetten (Sarstedt AG&Co, Nümbrecht, Deutschland) gewonnen. Die Proben wurden anschließend unmittelbar zur Sofortanalytik ins Zentrallabor im selben Haus geschickt. Die Einhaltung der Nüchternzeiten wurde angestrebt, stellte allerdings kein Ausschlusskriterium bei Nichterreichen dar. Dies lag darin begründet, dass weder in den deutschen Leitlinien zur Eisenmangelanämiediagnostik der AWMF [23], noch in Berichten der WHO zur Beurteilung des Eisenstatus danach verlangt wird [24]. Bei der zur Verfügung stehenden Studienpopulation gab es keinen Hinweis auf ikterische, lipämische oder hämolytische Proben. Für die Laboranalyse des großen Blutbildes (inklusive Retikulozyten) wurde eine automatische Hämatologie-Analyseeinheit für die In-vitro-Diagnostik in klinischen Labors der Firma Sysmex Corporation aus der XN-Serie (Sysmex XN-9000, Sysmex Deutschland GmbH, Norderstedt, Deutschland) verwendet. Dieses Gerät ermöglicht eine quantitative Ermittlung und Analyse der Bestandsverhältnisse sowie eine Kennzeichnung der detektierbaren Blut- und Körperflüssigkeitskomponenten, speziell für Hämoglobin mittels Sodium-Lauryl-Sulfat-Hämoglobin-Methode und für Retikulozyten mittels Fluoreszenz-Durchflusszytometrie mit Halbleiterlasertechnologie. Transferrin wurde durch immunologische Trübungstests mittels cobas 8000 (c-Modul) und Ferritin durch Elektrochemilumineszenz-Immunoassays mittels cobas 8000 (e-Modul) (jeweils Roche Diagnostics GmbH, Mannheim, Deutschland) ermittelt. Die analytischen Testverfahren wurden entsprechend der Herstellervorgaben durchgeführt. Zur Anwendung kamen ausschließlich für die Patientenversorgung zugelassene, CE-IVD-zertifizierte Tests. Zur Bestimmung der Interassay-Variationskoeffizienten wurden die Ergebnisse der täglichen Qualitätskontrollmessungen exemplarisch für den Monat Februar 2014 herangezogen. Der Interassay-Variationskoeffizient lag hierbei geräte- und zielwertabhängig für die Hämoglobinmessungen zwischen 0,5%–1,3% (Zielwerte 3,8/7,4/10,3 mmol/L, n=28–37, gemessen an drei Modulen), für die Retikulozytenmessungen zwischen 2,3%–5% (Zielwerte 50,4/23,4/8,9 ‰, n=28–37, gemessen an zwei Modulen), für die Ferritinmessungen bei 2,7% bzw. 1,7% (Zielwerte 23,7 bzw. 184 ng/mL, n=50 bzw. 44) sowie für die Transferrinmessungen bei 2,4% (Zielwerte 2,01 bzw. 3,28 g/L, n=47 bzw. 40). Die jeweilige Wertelage war repräsentativ für die übrigen Messzeiträume, auf eine Bestimmung von Intraassay-Variationskoeffizienten wurde bei niedrigen Interassay-Variationskoeffizienten verzichtet.
Statistische Analysen
Bei der Wahl der statistischen Methodik wurde die Leitlinie zur Erstellung von Referenzintervallen der IFCC [25] sowie die Empfehlungen der WHO zur Perzentilenschätzung [26], die für anthropometrische Parameter ausgearbeitet wurden, aber zunehmend auch für andere Parameter verwendet werden, herangezogen. Als untere und obere Referenzwerte galten, wie durch die IFCC empfohlen, jeweils die 2,5. und 97,5. Perzentile [25]. Aus den Empfehlungen der WHO wurde eine angepasste LMS(λ-μ-σ)-Methode nach Cole, Rigby und Stasinopoulos verwendet [27, 28], welche in das GAMLSS-Paket der Statistiksoftware R [29–31] implementiert ist. Diese wurde unter Annahme einer Box-Cox Power Exponential Verteilung (BCPE), welche normale, steilgipflige und flachgipflige Verteilungen abbilden kann und damit sehr flexibel ist, verwendet. Dadurch konnte eine Normalisierung der altersabhängigenVerteilung erreicht werden, welche Voraussetzung für die Ermittlung von Referenzintervallen ist. Diese Verteilungen werden durch die Parameter Median (location parameter, μ, M), Variationskoeffizient (scale parameter, σ, S), Schiefe (λ, L) und Krümmung (shape parameters) als Funktion des Alters charakterisiert [32, 33]. Der Ansatz, die Parameter als kontinuierliche Funktion des Alters zu schätzen, wurde bevorzugt, da dieser die physiologische Entwicklung besser modelliert als eine stufenweise Betrachtung verschiedener Altersintervalle [27]. Aufgrund des longitudinalen Designs existierten einerseits mehrere Messzeitpunkte je Proband. Andererseits setzte sich die Kohorte aus 1346 Familien zusammen, die teilweise mit mehreren Kindern teilnahmen. Um die Unabhängigkeit der Messpunkte zu gewährleisten, aber auch alle Messpunkte (und damit Informationen) in die Modellierung mit einbeziehen zu können, wurde eine Resampling-Technik angewandt. Die Zuweisung der Subsample erfolgte im ersten Schritt durch Begrenzung der Familien auf 600 und im zweiten Schritt durch Auswahl eines Messwertes pro Familie. Die Restriktion der Anzahl der Familien war notwendig, da einige Familien nur einen Messwert aufwiesen und die Wahrscheinlichkeit diesen Messwert in eine Berechnung einzubeziehen kleiner als eins sein sollte. Die Subsamplegröße von 600 Werten erwies sich in diesem Fall als akzeptable Teilmenge, um eine größtmögliche Anzahl an Messwerten bei gleichzeitig ausreichender Sampling-Auswahl zu ermöglichen. Das Sampling eines Messwertes pro Proband bei mehreren Besuchen erfolgte kongruent zum Familiensampling. Dabei wurden die Wichtungen so gewählt, dass die Ziehung aller Messwerte gleich wahrscheinlich war. Es erfolgte daraufhin die Berechnung der jeweiligen Modelle jeweils 1000-mal auf Grundlage der Subsample von jeweils 600 unabhängigen Werten. In Abbildung 2 sind diese Berechnungen als graue Einzelkurven dargestellt. Die mittleren geschätzten Parameter (location, shape, scale) wurden der Berechnung der Referenzwerte zugrunde gelegt und sind in Abbildung 2 als schwarze Kurven dargestellt. Aufgrund der geringeren Probandenzahlen in den äußeren Altersbereichen beschränkten sich die Schätzungen auf den Altersabschnitt vom 3. bis zum 16. Lebensjahr (Gesamt: n=2522, Jungen: n=1312, Mädchen n=1210). Um die Beeinflussung der Parameter Ferritin und Transferrin durch Infektionen zu beurteilen wurden die Berechnungen für diese Parameter zusätzlich mit einem bereinigten Datensatz durchgeführt, der keine Messzeitpunkte mit gleichzeitig erhöhtem CRP (≥ 5 mg/L) beinhaltete (Gesamt: n=2446, Jungen: n=1275, Mädchen n=1171). Zur weiteren deskriptiven Auswertung wurde zusätzlich PASW Statistics für Windows Version 18.0 (SPSS Inc., Chicago, IL, USA) verwendet.
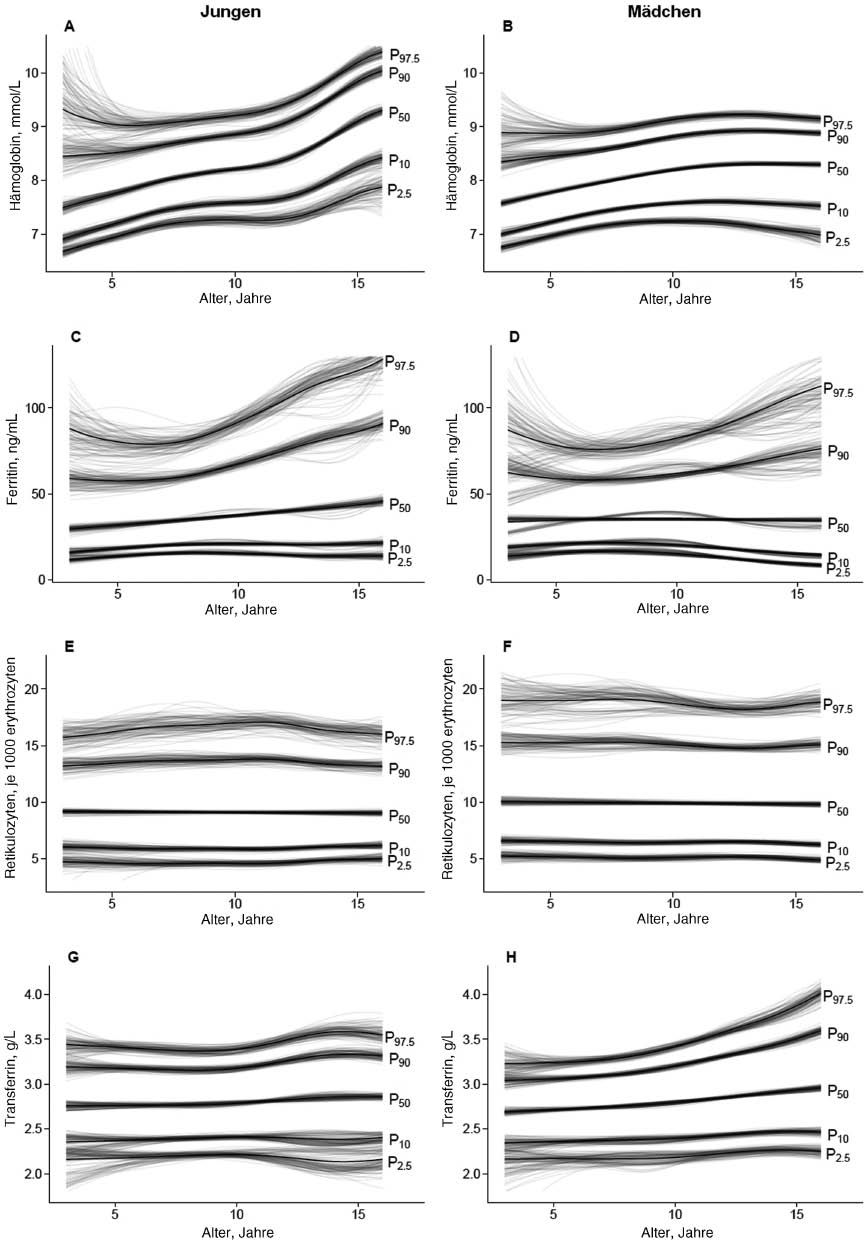
Geglättete Perzentilenkurven über das Alter (3 bis 16 Jahre) basierend auf der Referenzpopulation der LIFE Child Kohorte.
Die Einzelkurven sind grau und die gemittelten Kurven sind schwarz für die 2,5. (P 2.5), 10. (P 10), 50. (P 50), 90. (P 90) und 97,5. Perzentile (P 97.5) dargestellt. (A) Hämoglobinkurven (mmol/L) für Jungen. (B) Hämoglobinkurven (mmol/L) für Mädchen. (C) Ferritinkurven (ng/mL) für Jungen. (D) Ferritinkurven (ng/mL) für Mädchen. (E) Retikulozytenkurven (je 1000 Erythrozyten) für Jungen. (F) Retikulozytenkurven (je 1000 Erythrozyten) für Mädchen. (G) Transferrinkurven (g/L) für Jungen. (H) Transferrinkurven (g/L) für Mädchen.
Ergebnisse
Mithilfe der angepassten statistischen Methodik (Resampling) unter Verwendung des GAMLSS-Pakets der Statistiksoftware R konnten für die Parameter Hämoglobin, Ferritin, Transferrin und Retikulozyten Referenzintervalle (2,5. und 97,5. Perzentile) sowie geglättete Perzentilenkurven (2,5., 10., 50., 90. und 97,5. Perzentile) kontinuierlich über das Alter und getrennt nach Geschlecht erstellt werden. Es konnten halbjährliche Stützpunkte der jeweiligen Parameter für obere und untere Referenzgrenze (2,5. und 97,5. Perzentile), Median (M), Variationskoeffizient (S) und Schiefe (L) ermittelt werden (tabellarisch im Supplement zusammengefasst). Aufgrund des statistischen Vorgehens lagen durch die 1000-fachen Berechnungen der jeweiligen Modelle ebenso viele Einzelkurven vor, die einen Überblick über die potentiellen Schwankungen der einzelnen Parameterverläufe gaben. Desweiteren konnte durch die Mittelung dieser Einzelkurven eine stabile Kurvenverlaufsbeurteilung abgebildet werden. Diese Verläufe wurden im Folgenden für die einzelnen Parameter beschrieben.
Die Hämoglobinkonzentration stieg im Mittel von 7,5 mmol/L im Alter von 3 Jahren auf 8,3 mmol/L im Alter von 11 Jahren an. Nach Erreichen dieses Alters zeigte sich eine stärkere geschlechtsspezifische Verteilung. Diese zeichnete sich durch Stagnation der Kurven bei den Mädchen und einem starkem Anstieg der Kurven bei den Jungen aus. Mädchen wiesen dabei durchgängig einen Median von 8,3 mmol/L auf, während für Jungen ein Anstieg des Medians auf 9,3 mmol/L im Alter von 16 Jahren zu verzeichnen war. Die Referenzintervalle (P 2,5–P 97,5) erstreckten sich beispielhaft über 6,7–9,3 mmol/L für Jungen und 6,8–8,9 mmol/L für Mädchen im Alter von 3 Jahren, über 7,3–9,3 mmol/L für Jungen und 7,2–9,2 mmol/L für Mädchen im Alter von 11 Jahren bis hin zu 7,9–10,4 mmol/L für Jungen und 7,0–9,1 mmol/L für Mädchen im Alter von 16 Jahren (Supplement, Tabelle 1). Bei Betrachtung der Hämoglobin-Einzelkurven zeigten sich unscharfe Obergrenzen (P 90, P 97,5) für Kinder unter 5 Jahren, mit stärkeren Schwankungen bei Jungen als bei Mädchen sowie unscharfe Untergrenzen (P 2,5) für Jungen über 15 Jahren.
Für Ferritin zeigte sich bei den Kurven der 90. und 97,5. Perzentilen eine Verringerung der Konzentrationen (P 97,5) von 88,0 ng/mL bei Jungen und 87,2 ng/mL bei Mädchen im Alter von 3 Jahren auf 78,9 ng/mL bei Jungen und 75,8 ng/mL bei Mädchen im Alter von 6,5 Jahren. Daraufhin verzeichneten diese Kurven einen kontinuierlichen Anstieg bis zum Alter von 16 Jahren, der bei Jungen mit einem Erreichen von 128,4 ng/mL stärker ausgeprägt war als bei Mädchen mit einem Erreichen von 112,7 ng/mL. Die Kurven der 2,5. und 10. Perzentilen blieben über das gesamte Alter weitestgehend konstant, wobei bei den Mädchen ein leichter Abwärtstrend ab einem Alter von 8 Jahren mit Konzentrationen (P 2,5) von 16,6 ng/mL auf 8,2 ng/mL im Alter von 16 Jahren zu verzeichnen waren. Die Kurven zur 50. Perzentile waren bei Jungen über das gesamte Alter hinweg leicht ansteigend mit 29,7 ng/mL im Alter von 3 Jahren bis 45,7 ng/mL im Alter von 16 Jahren, bei den Mädchen blieben sie hingegen weitestgehend unverändert zwischen 33,81 und 35,91 ng/mL (Supplement, Tabelle 2). Die Ferritin-Einzelkurven wiesen sowohl für Jungen als auch für Mädchen potentielle Schwankungen der Obergrenzen (P 90, P 97,5) über den gesamten Altersbereich auf. Außerdem wurde die Abspaltung einer Subgruppe (vor allem bei Mädchen) deutlich. Es zeigte sich eine Einzelkurvengruppierung, die über alle Perzentilenkurven hinweg, allerdings verstärkt ab der 50. Perzentile, deutlich niedrigere Konzentrationen im Alter von 3 Jahren, ansteigende Konzentrationen bis zum Alter von 11 Jahren und einen kurzen Abfall der Konzentrationen mit anschließend nahezu konstantem Verlauf im Gegensatz zu den gemittelten Kurven aufwies. Da Ferritin ein Akute-Phase-Protein ist, wurde die Perzentilenerstellung ebenfalls unter Ausschluss aller Messzeitpunkte, bei denen zum selben Zeitpunkt eine CRP-Erhöhung (≥5 mg/L) vorlag, durchgeführt. Die geschätzten Referenzintervalle unterschieden sich bezüglich der unteren Referenzgrenze um maximal 0,7 ng/mL und hinsichtlich der oberen Referenzgrenze um maximal 6,5 ng/mL von den Werten des gesamten Datensatzes.
Der relative Retikulozytenanteil wies bei Jungen über das gesamte Kindes- und Jugendalter einen konstanten Verlauf auf. Durchgängig lag der Median bei Jungen zwischen 9,1 und 9,2 je 1000 Erythrozyten und das Referenzintervall (P 2,5–P 97,5) zwischen 4,7 und 5,0–15,7 und 16,0 je 1000 Erythrozyten. Bei Mädchen zeigte sich insgesamt eine größere Variabilität, wobei der Median zwischen 9,8 und 10,1 je 1000 Erythrozyten und das Referenzintervall (P 2,5–P 97,5) zwischen 4,9 und 5,3–18,2 und 19,0 je 1000 Erythrozyten lag (Supplement, Tabelle 3). Die Obergrenzen (P 97,5) der Retikulozyten-Einzelkurven stellten sich über den gesamten Altersbereich unscharf dar.
Auch die Transferrinkonzentrationen zeigten insgesamt einen beständigen Verlauf über das Alter. Bei Mädchen zeichnete sich ein leichter Anstieg der 50., 90. und 97,5. Perzentilenkurven ab. Insgesamt war die Spanne allerdings gering. Der Median lag zwischen 2,7 und 3,0 g/L und der Referenzbereich (P 2,5–P 97,5) zwischen 2,2 und 2,3–3,2 und 4,0 g/L (Supplement, Tabelle 4). Die Einzelkurven des Transferrins zeigten geringe potentielle Schwankungen der Ober- (P 97,5) und Untergrenzen (P 2,5) bei Jungen in den äußeren Altersbereichen (unter 5 Jahren und über 13 Jahren) und bei Mädchen nur in den unteren Altersbereichen (unter 5 Jahren). Da Transferrin ein Anti-Akute-Phase-Protein ist, wurde die Perzentilenerstellung ebenfalls unter Ausschluss aller Messzeitpunkte, bei denen zum selben Zeitpunkt eine CRP-Erhöhung (≥5 mg/L) vorlag, durchgeführt. Die geschätzten Referenzintervalle unterschieden sich nicht von denen des gesamten Datensatzes.
Diskussion
Die Anwendung der LMS-Methode nach Cole, welche in das GAMLSS-R-Paket eingebettet ist, kann als adäquate Methode zur Schätzung von pädiatrischen Referenzintervallen dargestellt werden. Durch die Anwendung der beschriebenen Resampling-Methode können einerseits mehrere Messzeitpunkte pro Proband und Familie einbezogen werden und andererseits potentielle Schwankungen in Form von Einzelkurven, sowie stabile Verläufe durch Mittelung der Einzelkurven dargestellt werden. Die Verläufe können kontinuierlich über das Alter dargestellt werden, was nicht nur durch die WHO [26] empfohlen ist, sondern auch die willkürliche Einteilung von Altersintervallen umgeht und physiologische Vorgänge besser abbildet. Die pädiatrischen Referenzintervalle für die Parameter Hämoglobin, Ferritin, Retikulozyten und Transferrin wurden vorher noch nicht mit den hier verwendeten Analysegeräten Sysmex XN-9000 und Roche cobas 8000 c- und e-Modul erarbeitet. Dadurch wird sowohl den Forderungen der IFCC [25], bei neuen Analysemethoden Referenzintervalle zu erheben, als auch den Forderungen der Gerätehersteller [34] zur Verifizierung an der eigenen Referenzpopulation, nachgegangen.
Hämoglobin zeigt mit dem beschriebenen Konzentrationsanstieg bis zum 11. Lebensjahr und dem anschließenden Einsetzen eines geschlechtsbezogenen Verlaufes, der gekennzeichnet ist durch relativ konstante Konzentrationen für Mädchen und starkem Anstieg bei Jungen, einen typischen, durch vorherige Studien [10, 12, 17, 19, 35, 36] bestätigten Trend. Dieser lässt sich allgemein auf das Wachstum während der kindlichen Entwicklung zurückführen. Mit Eintritt der Pubertät lassen sich die Unterschiede abhängig vom Geschlecht vor allem durch hormonelle Beeinflussung (Erythropoetinstimulation durch Androgene, -hemmung durch Östrogene), sowie durch Einsetzen der Menstruation (Blutverluste) bei Mädchen erklären. Aufgrund der geographischen Nähe, Aktualität und der Beschreibung kontinuierlicher Ergebnisse bieten sich die Studien von KiGGS [16] und Zierk et al. [17] zum Vergleich an. Im Vergleich der in dieser Studie berechneten Referenzintervalle und denen von KiGGS (P 3–P 97) zeigen sich bezüglich der unteren Referenzgrenzen mittlere Abweichungen von 0,17 g/dL (maximale Abweichung: 0,38 g/dL) für Jungen und von 0,07 g/dL (maximale Abweichung: 1,66 g/dL) für Mädchen. Bezüglich der oberen Referenzgrenzen zeigen sich mittlere Abweichungen von 0,66 g/dL (maximale Abweichung: 1,65 g/dL) für Jungen und von 0,11 g/dL (maximale Abweichung: 1,76 g/dL) für Mädchen. Im Vergleich der in dieser Studie berechneten Referenzintervalle und denen von Zierk (P 2,5–P 97,5) zeigen sich bezüglich der unteren Referenzgrenzen mittlere Abweichungen von 0,34 g/dL (maximale Abweichung: 0,39 g/dL) für Jungen und von 0,25 g/dL (maximale Abweichung: 0,7 g/dL) für Mädchen. Bezüglich der oberen Referenzgrenzen zeigen sich mittlere Abweichungen von 0,12 g/dL (maximale Abweichung: 1,15 g/dL) für Jungen und von 0,19 g/dL (maximale Abweichung: 0,7 g/dL) für Mädchen. Insgesamt stellen sich somit nur geringe Abweichungen zu den benannten Studien dar. Die auftretenden Abweichungen sind am ehesten auf unterschiedliche Analysegeräte im Labor zurückzuführen. Aufgrund der technischen Besonderheiten der unterschiedlichen Analysegeräte (von unterschiedlichen Herstellern, aber auch unterschiedlicher Modelle eines Herstellers) ist eine komplette Übereinstimmung der generierten Messwerte nahezu ausgeschlossen [37]. Wobei vor allem zum Hämoglobin belegt ist, dass die Unterschiede zwischen verschiedenen Analysegeräten im Vergleich zu anderen hämatologischen Parametern gering sind [38]. Weiterhin lassen sich die Unterschiede auch auf unterschiedliche Ein- und Ausschlusskriterien, aber auch auf die unterschiedlichen statistischen Vorgehensweisen der verschiedenen Studien zurückführen.
Ferritin weist einen eher konstanten Verlauf der unteren Perzentilen (P 2,5, P 10) auf, während die oberen Perzentilen (P 90, P 97,5) durch einen Anstieg ab einem Alter von 6,5 Jahren geprägt sind. Dabei steigen bei männlichen Jugendlichen die Werte im Vergleich zu den Mädchen stärker an. Ferritin speichert Eisen in Leber, Knochenmark, Milz und anderen Geweben, wie beispielsweise Muskulatur. Die Zunahme des Ferritins ab einem Alter von 6,5 Jahren sowie die geschlechtsspezifischen Unterschiede sind wahrscheinlich durch Wachstum, Organreifeprozesse und hormonelle Veränderungen sowie Einsetzen der Menstruation in der Pubertät bedingt. Die Perzentilenerstellung unter Ausschluss von Messzeitpunkten mit erhöhtem CRP zeigt kaum Abweichungen von der Berechnung, in welcher alle Messzeitpunkte einbezogen sind. Dies spricht dafür, dass der statistische Ansatz mit der Schätzung der gemittelten Perzentilenkurven pathologische Veränderungen in gewissem Maße ausgleichen kann. Die Darstellung der Ergebnisse fiel daher zu Gunsten einer höheren Datenmenge aus und führt somit in Tabellen und Abbildungen den gesamten Datensatz auf. Im Vergleich der in dieser Studie berechneten Referenzintervalle und denen von KiGGS (P 3–P 97) [16] zeigen sich bezüglich der unteren Referenzgrenzen mittlere Abweichungen von 3,07 ng/mL (maximale Abweichung: 5,39 ng/mL) für Jungen und von 4,07 ng/mL (maximale Abweichung: 6,22 ng/mL) für Mädchen. Bezüglich der oberen Referenzgrenzen zeigen sich mittlere Abweichungen von 25,25 ng/mL (maximale Abweichung: 42,27 ng/mL) für Jungen und von 18,81 ng/mL (maximale Abweichung: 31,33 ng/mL) für Mädchen. Die Vergleichbarkeit zu anderen Studien ist eingeschränkt aufgrund des unterschiedlichen Ansatzes der kontinuierlichen Referenzintervallbestimmung und der generellen Trennung nach Geschlecht in der vorliegenden Studie und den zumeist für Altersgruppen und nicht durchgängig geschlechtsabhängig bestimmten Referenzintervallen in anderen Studien. Allgemein betrachtet finden sich in der CALIPER-Studie [14] aber niedrigere untere Referenzgrenzen im Vergleich zu der vorliegenden Arbeit oder der KiGGS-Studie. Eine mögliche Erklärung könnte die Rekrutierung hospitalisierter Patienten sein, bei denen zwar metabolische Störungen ausgeschlossen wurden, aber zum Beispiel orthopädische Patienten eingeschlossen sind, sodass klinische Komponenten eine Rolle spielen könnten. In einer US-amerikanischen Studie von 2004 [39] weisen die Ferritinkonzentrationen eine große Variabilität auf, die vor allem mit höheren oberen Referenzgrenzen als bei der vorliegenden Studie einhergehen. Nur im Jugendalter können ähnlich große Variabilitäten von der 2,5. bis 97,5. Perzentile bei uns aufgezeigt werden. Auch dies könnte darauf zurückgeführt werden, dass in der erwähnten Studie hospitalisierte Patienten die Referenzindividuen bilden. Die benannten Abweichungen sind mit großer Wahrscheinlichkeit auf die unterschiedliche Rekrutierung der verschiedenen Studienpopulationen zurückzuführen. Weiterhin gibt es Anhalte dafür, dass auch im Falle von Ferritin die Verwendung unterschiedlicher Analysegeräte ausschlaggebend für die unterschiedlichen Ergebnisse ist [40].
Zieht man die von der WHO [41] herausgegebenen Cut-Off-Werte für Hämoglobin und Ferritin zur Eisenmangelanämie-Diagnostik zum Vergleich heran, decken sich diese nur teilweise sowohl mit den von uns beobachteten Ergebnissen, als auch mit denen der KiGGS- [16] und Zierk-Studie [17]. Die WHO unterscheidet Hämoglobin-Cut-Off-Werte abhängig vom Geschlecht erst ab einem Alter von 15 Jahren. Allerdings werden geschlechtsspezifische Unterschiede in der aktuellen Auswertung schon ab einem Alter von 11 Jahren deutlich. Allgemein unterschreiten die Mädchen ab 12 Jahren nach den ermittelten unteren Referenzgrenzen die beschriebenen Cut-Off-Werte der WHO. Für Ferritin ist diese Unterschreitung der herausgegebenen WHO-Cut-Off-Werte im Vergleich zu der vorliegenden und der KiGGS-Studie sogar noch größer und zeichnet sich bei Mädchen ab 11 Jahren ab. Eine Aktualisierung der bisher von der WHO benannten Cut-Off-Werte zur Eisenmangelanämie-Diagnostik sollte daher in Betracht gezogen werden.
Die Retikulozytenzahlen verbleiben über den gesamten Altersbereich weitestgehend konstant mit 5 bis 19 je 1000 Erythrozyten und damit ähnlich zu einer vorbeschriebenen Spanne von 5 bis 15 je 1000 Erythrozyten [35]. Bisherige Daten zu Retikulozytenzahlen sind uneinheitlich und aufgrund ihrer unterschiedlichen Darstellung in Absolut- und Relativwerten nur bedingt vergleichbar. Auch Schwankungen in Abhängigkeit von verschiedenen Analysegeräten werden in der Literatur mehrfach beschrieben [38, 42, 43]. Von der Sysmex GmbH werden abnehmende Tendenzen zum Erwachsenenalter beschrieben [37], was teilweise mit der vorliegenden Studie übereinstimmt. Allerdings zeigen sich im Gegensatz zu den Sysmex-Referenzen niedrigere untere Referenzgrenzen und zumeist höhere obere Referenzgrenzen vor allem bei Mädchen. In einer schwedischen Arbeit mit Kindern zwischen 8 und 18 Jahren konnten geschlechtsbezogene Unterschiede mit höheren Konzentrationen für Mädchen nachgewiesen werden [19]. In der vorliegenden Studie ist dies vor allem bezüglich der oberen Perzentilen (P 50, P 90, P 97,5) nachweisbar. Die Retikulozyten stellen die letzte unreife Vorstufe der Erythrozyten dar und müssen dementsprechend dauerhaft neu gebildet werden, um den Abbau der Erythrozyten zu decken, weswegen unter physiologischen Bedingungen ein kontinuierlich gleicher Retikulozytenanteil nötig ist.
Transferrin stellt sich insgesamt mit einem kontinuierlichen Verlauf dar, der durch eine Zunahme der Variabilität bei Mädchen ab einem Alter von 12 Jahren gekennzeichnet ist. Dies wird durch eine Vielzahl an Studien bestätigt [13–15, 18, 19], in einigen aber auch kontrovers dargestellt [39, 44]. Allerdings muss beachtet werden, dass die Veränderungen in einer so geringen Spanne liegen, dass von keinem relevanten geschlechtsspezifischen Unterschied ausgegangen werden kann. Sodass die Übereinstimmung der Referenzintervalle zwischen verschiedenen Studien gut ist. Transferrin fungiert als Transportprotein, das den Austausch von Eisen zwischen Darm, Eisenspeichern und Erythroblasten ermöglicht. Es reagiert auf Eisenmangel mit einer Erhöhung, scheint aber nicht direkt von physiologischen Entwicklungsprozessen beeinflusst zu sein.
Die beschriebenen potentiellen Schwankungen der Einzelkurven in den äußeren Perzentilen und äußeren Altersbereichen sind Abbild einer geringeren Stabilität, begründet in einer geringeren Anzahl eingehender Messwerte (nur die äußeren 2,5%) sowie dem Fehlen von Datenpunkten außerhalb der äußeren Altersbereiche, die als Stützstellen fungieren könnten. Diese beiden Faktoren können allerdings durch die durchgeführte mittlere Schätzung der Einzelkurven gut ausgeglichen werden. Die weiterhin beschriebene Gruppierung von Einzelkurven des Ferritins lässt vermuten, dass eine Subgruppe mit einer gemeinsamen Eigenschaft besteht. Am wahrscheinlichsten ist, dass es sich hier um eine genetische Komponente handelt, wie beispielsweise der Darstellung eines bestimmten Ferritintypes (Isoferritin) [45, 46].
Durch die Untersuchungen können aktuelle Referenzintervalle zu Hämoglobin, Ferritin, Retikulozyten und Transferrin für Kinder und Jugendliche auf Grundlage einer primär gesunden, hoch standardisierten Probenpopulation zur Verfügung gestellt werden. Dies erfolgt erstmals für die verwendeten Gerätetechniken Sysmex XN-9000 und Roche cobas 8000 c- und e-Modul. Für die Erstellung der Perzentilenkurven und Referenzintervalle konnte das GAMLSS-Paket der Statistiksoftware R als probates Mittel bestätigt werden. Die Verläufe der Parameter wurden kontinuierlich über das Alter, erstmals für Retikulozyten und Transferrin, und nicht in Altersgruppen dargestellt, was zum einen physiologische Gegebenheiten (fließende Übergänge statt stufenweise Betrachtung) wiederspiegelt und dem Problem der willkürlichen Altersintervalleinteilung vorbeugt. Außerdem wird durch die angepasste statistische Methodik die Möglichkeit aufgezeigt, ein longitudinales Design für eine querschnittliche Studie zu nutzen. Weiterhin können Familienmitglieder einbezogen werden, ohne die für die Berechnungen notwendige Unabhängigkeit zu verletzen. Die wiederholten Modellberechnungen und die Mittelung der resultierenden Einzelkurven erhöhen die Zuverlässigkeit und rücken den Einfluss von Confoundern, wie im vorliegenden Fall CRP-Erhöhungen, in den Hintergrund. Weiterhin können durch die Einzelkurven potentielle Schwankungen oder Besonderheiten, wie die beschriebene Subgruppierung bei Ferritin, beurteilt werden. Durch die Erarbeitung von Übereinstimmungen und Abweichungen zu anderen Studien können einflussnehmende Faktoren, wie Analysegeräte, Ein- und Ausschlusskriterien, Art der Alters- (kontinuierlich oder gruppiert) und Geschlechtsbetrachtung (getrennt nach Geschlecht oder zusammengefasst), klinische Aspekte und statistische Methodik, sowie die IFCC-Empfehlung zur regelmäßigen Überarbeitung von Referenzintervallen untermauert werden. Unsere Studie macht dabei vor allem auf eine mögliche Überarbeitung der WHO-Referenzintervalle für Hämoglobin und Ferritin aufmerksam.
Danksagung: Diese Publikation wurde gefördert durch LIFE-Leipziger Forschungszentrum für Zivilisationserkrankungen. LIFE wird finanziert aus Mitteln der Europäischen Union durch den Europäischen Fonds für regionale Entwicklung (EFRE) und aus Mitteln des Freistaates Sachsen im Rahmen der Landesexzellenzinitiative.
Es handelt sich um eine interdisziplinäre Arbeit. Dabei erfolgte die Datenauswertung und die Manuskriptverfassung durch K. Rieger in Zusammenarbeit mit M. Vogel und C. Engel bezüglich der statistischen, mit U. Ceglarek, J. Thiery, J. Kratzsch und K. Harms bezüglich der laboratoriumsmedizinischen und mit F. Glock, A. Hiemisch und W. Kiess bezüglich der pädiatrischen Anteile. Wir bedanken uns für die gute Zusammenarbeit.
Autorenbeteiligung: Alle Autoren tragen Verantwortung für den gesamten Inhalt dieses Artikels und haben der Einreichung des Manuskripts zugestimmt.
Forschungsförderung: Keine.
Interessenkonflikt: Die Autoren geben an, dass kein wirtschaftlicher oder persönlicher Interessenkonflikt besteht. Alle beschriebenen Untersuchungen am Menschen wurden mit Zustimmung der zuständigen Ethik-Kommission (Reg. No. 264-10-19042010), im Einklang mit nationalem Recht sowie gemäß der Deklaration von Helsinki von 1975 (in der aktuellen, überarbeiteten Fassung) durchgeführt. Von allen beteiligten Probanden liegt eine Einverständniserklärung vor.
Literatur
1. World Health Organization. Prevalence and epidemiology of iron deficiency. In: World Health Organization, editor. Iron deficiency anaemia. Assessment, prevention, and control: a guide for programme managers. Geneva: WHO, 2001:15–7.Suche in Google Scholar
2. World Health Organization. Functional consequences of iron deficiency. In: World Health Organization, editor. Iron deficiency anaemia. Assessment, prevention, and control: a guide for programme managers. Geneva: WHO, 2001:7–10.Suche in Google Scholar
3. Halterman JS, Kaczorowski JM, Aligne CA, Auinger P, Szilagyi PG. Iron deficiency and cognitive achievement among school-aged children and adolescents in the United States. Pediatrics 2001;107:1381–6.10.1542/peds.107.6.1381Suche in Google Scholar PubMed
4. Kunz JB, Kulozik AE. Differenzialdiagnose der kindlichen Anämie. Monatsschr Kinderheilkd 2012;160:395–406.10.1007/s00112-012-2624-6Suche in Google Scholar
5. Nielsen P, Gaedicke G. Physiologie und Pathophysiologie des Eisenstoffwechsels. In: Gadner H, Gaedicke G, Niemeyer C, Ritter J (Hrsg). Pädiatrische Hämatologie und Onkologie. Berlin: Springer, 2006:101–10.10.1007/3-540-29036-2_7Suche in Google Scholar
6. DeLoughery TG. Microcytic Anemia. N Engl J Med 2014;371: 1324–31.10.1056/NEJMra1215361Suche in Google Scholar PubMed
7. Schnabl K, Chan MK, Adeli K. Pediatric reference intervals: critical gap analysis and establishment of a national initiative. Clin Biochem 2006;39:559–60.10.1016/j.clinbiochem.2006.03.009Suche in Google Scholar PubMed
8. Kohse KP. National and international initiatives and approaches for the establishment of reference intervals in pediatric laboratory medicine. LaboratoriumsMedizin 2015;39:197–212.10.1515/labmed-2015-0055Suche in Google Scholar
9. National health and nutrition examination survey, 1976-80. Bethesda, Md.: National Center for Health Statistics, 1982.Suche in Google Scholar
10. National Health and Nutrition Examination Survey, III, 1988-94. Public use data, Rev. Oct. 1997. NCHS CD-ROM. Series 11, no. 1. Hyattsville, Md.:U.S. Dept. of Health and Human Services, Centers for Disease Control and Prevention, National Center for Health Statistics, 1997.Suche in Google Scholar
11. Soldin SJ, Brugnara C, Wong EC. Pediatric reference intervals, 6th ed. Washington, DC: AACC Press, 2007.Suche in Google Scholar
12. Taylor MR, Holland CV, Spencer R, Jackson JF, O’Connor GI, O’Donnell JR. Haematological reference ranges for schoolchildren. Clin Lab Haematol, 1997;19:1–15.10.1046/j.1365-2257.1997.00204.xSuche in Google Scholar PubMed
13. Chan MK, Seiden-Long I, Aytekin M, Quinn F, Ravalico T, Ambruster D, et al. Canadian Laboratory Initiative on Pediatric Reference Interval Database (CALIPER): pediatric reference intervals for an integrated clinical chemistry and immunoassay analyzer, Abbott ARCHITECT ci8200. Clin Biochem 2009;42:885–91.10.1016/j.clinbiochem.2009.01.014Suche in Google Scholar PubMed
14. Blasutig IM, Jung B, Kulasingam V, Baradaran S, Chen Y, Chan MK, et al. Analytical evaluation of the VITROS 5600 Integrated System in a pediatric setting and determination of pediatric reference intervals. Clin Biochem 2010;43:1039–44.10.1016/j.clinbiochem.2010.05.011Suche in Google Scholar PubMed
15. Colantonio DA, Kyriakopoulou L, Chan MK, Daly CH, Brinc D, Venner AA, et al. Closing the gaps in pediatric laboratory reference intervals: a CALIPER database of 40 biochemical markers in a healthy and multiethnic population of children. Clin Chem 2012;58:854–68.10.1373/clinchem.2011.177741Suche in Google Scholar PubMed
16. Dortschy R, Schaffrath Rosario A, Scheidt-Nave C, Thierfelder W, Thamm M, Gutsche J, et al. Ergebnisse. In: Robert-Koch-Institut (Hrsg). Bevölkerungsbezogene Verteilungswerte ausgewählter Laborparameter aus der Studie zur Gesundheit von Kindern und Jugendlichen in Deutschland (KiGGS). Berlin: Robert-Koch-Inst, 2009:11–45.Suche in Google Scholar
17. Zierk J, Arzideh F, Haeckel R, Rascher W, Rauh M, Metzler M. Indirect determination of pediatric blood count reference intervals. Clin Chem Lab Med 2013;51:863–72.10.1515/cclm-2012-0684Suche in Google Scholar PubMed
18. Hilsted L, Rustad P, Aksglaede L, Sorensen K, Juul A. Recommended Nordic paediatric reference intervals for 21 common biochemical properties. Scand J Clin Lab Invest 2013;73: 1–9.10.3109/00365513.2012.721519Suche in Google Scholar PubMed
19. Aldrimer M, Ridefelt P, Rödöö P, Niklasson F, Gustafsson J, Hellberg D. Population-based pediatric reference intervals for hematology, iron and transferrin. Scand J Clin Lab Invest 2013;73:253–61.10.3109/00365513.2013.769625Suche in Google Scholar PubMed
20. Thierfelder W, Dortschy R, Hintzpeter B, Kahl H, Scheidt-Nave C. Biochemische Messparameter im Kinder- und Jugendgesundheitssurvey (KiGGS) (Biochemical measures in the German Health Interview and Examination Survey for Children and Adolescents (KiGGS)). Bundesgesundhbl Gesundheitsforsch Gesundheitsschutz 2007;50:757–70.10.1007/s00103-007-0238-2Suche in Google Scholar PubMed
21. Quante M, Hesse M, Döhnert M, Fuchs M, Hirsch C, Sergeyev E, et al. The LIFE child study: a life course approach to disease and health. BMC Public Health 2012;12:1021–34.10.1186/1471-2458-12-1021Suche in Google Scholar PubMed PubMed Central
22. Kromeyer-Hauschild K, Wabitsch M, Kunze D, Geller F, Geiß, HC, Hesse V, et al. Perzentile für den Body-mass-Index für das Kindes- und Jugendalter unter Heranziehung verschiedener deutscher Stichproben. Monatsschr Kinderheilkd 2001;149:807–18.10.1007/s001120170107Suche in Google Scholar
23. Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V. Langfassung der Leitlinie „Eisenmangelanämie“. Available at: http://www.awmf.org/leitlinien/detail/ll/025-021.html. Accessed: 31. August 2015.Suche in Google Scholar
24. World Health Organization, Centers for Disease Control and Prevention. Assessing the iron status of populations. Second edition, including Literature Reviews. Geneva, [Atlanta, Ga.]:World Health Organization, Dept. of Nutrition for Health and Development; Centers for Disease Control and Prevention, Division of Nutrition and Physical Activity, International Micronutrient Malnutrition Prevention and Control Program, 2007.Suche in Google Scholar
25. Horowitz GL. Defining, establishing, and verifying reference intervals in the clinical laboratory. Approved guideline, 3rd ed. Clinical and Laboratory Standards Institute, C28-A3 = v. 28, no. 30. Wayne, Pa.: Clinical and Laboratory Standards Institute, 2008.Suche in Google Scholar
26. Borghi E, Onis M de, Garza C, Van den Broeck J, Frongillo EA, Grummer-Strawn L, et al. Construction of the World Health Organization child growth standards: selection of methods for attained growth curves. Stat Med 2006;25:247–65.10.1002/sim.2227Suche in Google Scholar PubMed
27. Cole TJ, Green PJ. Smoothing reference centile curves: the LMS method and penalized likelihood. Stat Med 1992;11:1305–19.10.1002/sim.4780111005Suche in Google Scholar PubMed
28. Cole TJ, Stanojevic S, Stocks J, Coates AL, Hankinson JL, Wade AM. Age- and size-related reference ranges: a case study of spirometry through childhood and adulthood. Stat Med 2009;28:880–98.10.1002/sim.3504Suche in Google Scholar PubMed PubMed Central
29. R Core Team. R: A Language and Environment for Statistical Computing. Available at: http://www.R-project.org/.Suche in Google Scholar
30. Rigby RA, Stasinopoulos DM. Generalized additive models for location, scale and shape,(with discussion). J R Stat Soc Ser C Appl Stat 2005;54:507–54.10.1111/j.1467-9876.2005.00510.xSuche in Google Scholar
31. Stasinopoulos DM, Rigby RA. Generalized Additive Models for Location, Scale and Shape (GAMLSS) for Modeling Reference. J Stat Softw 2007;23:1–46.10.18637/jss.v023.i07Suche in Google Scholar
32. Box GEP, Cox DR. An analysis of transformation. J R Stat Soc Series B Stat Methodol 1964:211–52.Suche in Google Scholar
33. Rigby RA, Stasinopoulos DM. Smooth centile curves for skew and kurtotic data modelled using the Box-Cox power exponential distribution. Stat Med 2004;23:3053–76.10.1002/sim.1861Suche in Google Scholar PubMed
34. Sysmex Deutschland GmbH. „Referenzwerte“ – Haben Sie da etwas von Sysmex? Available at: http://www.sysmex.de/akademie/wissenszentrum/haematologie/referenzbereiche.html. Accessed: 29.11.2015.Suche in Google Scholar
35. Heil W, Ehrhardt V. Reference ranges for adults and children: pre-analytical considerations. Mannheim: Roche Diagnostics GmbH, 2008.Suche in Google Scholar
36. Sysmex Austria GmbH. Pädiatrische Referenzintervalle für das Analysensystem Sysmex XE-2100. Available at: http://www.sysmex.de/fileadmin/media/f101/Xtra/Themenblaetter/14.1.05_Paediatrische_Referenzintervalle_RZ_Web.pdf. Accessed: 29.11.2015.Suche in Google Scholar
37. Sysmex Deutschland GmbH. Die Erythrozytenindices. Available at: http://www.sysmex.ch/fileadmin/media/f114/Xtra/Themenblaetter/Die_Erythrozytenindizes_-_Xtra_Schweiz_Fruehjahr_2013.pdf. Accessed: 29.11.2015.Suche in Google Scholar
38. Bruegel M, Nagel D, Funk M, Fuhrmann P, Zander J, Teupser D. Comparison of five automated hematology analyzers in a university hospital setting: Abbott Cell-Dyn Sapphire, Beckman Coulter DxH 800, Siemens Advia 2120i, Sysmex XE-5000, and Sysmex XN-2000. Clin chem Lab Med 2015;53:1057–71.10.1515/cclm-2014-0945Suche in Google Scholar
39. Soldin OP, Bierbower LH, Choi JJ, Choi JJ, Thompson-Hoffman S, Soldin SJ. Serum iron, ferritin, transferrin, total iron binding capacity, hs-CRP, LDL cholesterol and magnesium in children; new reference intervals using the Dade Dimension Clinical Chemistry System. Clin Chim Acta 2004;342:211–7.10.1016/j.cccn.2004.01.002Suche in Google Scholar
40. Zhang X, Lu Y, Ma L, Peng Q, Qin X, Li S. A comparison study between two analyzers for determining serum ferritin. Clin Lab 2015;61:169–74.10.7754/Clin.Lab.2014.140807Suche in Google Scholar
41. World Health Organization. Methods of assessing iron status. In: World Health Organization (Hrsg). Iron deficiency anaemia. Assessment, prevention, and control: a guide for programme managers. Geneva: WHO, 2001:33–8.Suche in Google Scholar
42. d’Onofrio G, Kim YR, Schulze S, Lorentz T, Dorner K, Goossens W, et al. Evaluation of the Abbott Cell Dyn 4000 automated fluorescent reticulocyte measurements: comparison with manual, FACScan and Sysmex R1000 methods. Clin Lab Haematol 1997;19:253–60.10.1046/j.1365-2257.1997.00078.xSuche in Google Scholar
43. Van den Bossche, J, Devreese K, Malfait R, Van de Vyvere, M, Schouwer P de. Comparison of the reticulocyte mode of the Abx Pentra 120 Retic, Coulter General-S, Sysmex SE 9500, Abbott CD 4000 and Bayer Advia 120 haematology analysers in a simultaneous evaluation. Clin Lab Haematol 2001;23:355–60.10.1046/j.1365-2257.2001.00420.xSuche in Google Scholar
44. Lockitch G, Halstead AC, Wadsworth L, Quigley G, Reston L, Jacobson B. Age- and sex-specific pediatric reference intervals and correlations for zinc, copper, selenium, iron, vitamins A and E, and related proteins. Clin Chem,1988;34: 1625–8.10.1093/clinchem/34.8.1625Suche in Google Scholar
45. Powell LW, Alpert E, Isselbacher KJ, Drysdale JW. Human isoferritins: organ specific iron and apoferritin distribution. Br J Haematol,1975;30:47–55.10.1111/j.1365-2141.1975.tb00516.xSuche in Google Scholar
46. McKeering LV, Halliday JW, Caffin JA, Mack U, Powell LW. Immunological detection of isoferritins in normal human serum and tissue. Clin Chim Acta 1976;67:189–97.10.1016/0009-8981(76)90259-XSuche in Google Scholar
Supplemental Material
The online version of this article (DOI: 10.1515/labmed-2015-0093) offers supplementary material, available to authorized users.
©2016 by De Gruyter
This article is distributed under the terms of the Creative Commons Attribution Non-Commercial License, which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Artikel in diesem Heft
- Frontmatter
- Hämostaseologie/Hemostaseology /Redaktion: M. Orth
- Reflections on the next generation of hemostasis instrumentation. A glimpse into the future?
- Endokrinologie/Endocrinology / Redaktion: M. Bidlingmaier/J. Kratzsch
- Schilddrüsenerkrankungen: Diagnostik und Therapiekontrolle 2015
- Performance characteristics of Elecsys free βhCG and PAPP-A for first trimester trisomy 21 risk assessment in gestational weeks 8+0 to 14+0
- Referenzintervalle für eisenabhängige Blutparameter bei Kindern und Jugendlichen: Ergebnisse einer populationsgestützten Kohortenstudie (LIFE Child)
- Originalartikel/Original Article
- Relationship of fetuin-A with restenosis in patients who underwent revascularization
- In-vitro hemolysis and its financial impact using different blood collection systems
- Leserbrief/Letter to the Editor
- Betreff Cadamuro et al.: In-vitro hemolysis and its financial impact using different blood collection systems
- Antwort auf A. von Meyer: Cadamuro et al. In-vitro Hämolyse verschiedener Blutabnahmesysteme sowie deren finanzielle Auswirkung
- Buchbesprechung/Book Review
- Pre-examination procedures in laboratory diagnostics
Artikel in diesem Heft
- Frontmatter
- Hämostaseologie/Hemostaseology /Redaktion: M. Orth
- Reflections on the next generation of hemostasis instrumentation. A glimpse into the future?
- Endokrinologie/Endocrinology / Redaktion: M. Bidlingmaier/J. Kratzsch
- Schilddrüsenerkrankungen: Diagnostik und Therapiekontrolle 2015
- Performance characteristics of Elecsys free βhCG and PAPP-A for first trimester trisomy 21 risk assessment in gestational weeks 8+0 to 14+0
- Referenzintervalle für eisenabhängige Blutparameter bei Kindern und Jugendlichen: Ergebnisse einer populationsgestützten Kohortenstudie (LIFE Child)
- Originalartikel/Original Article
- Relationship of fetuin-A with restenosis in patients who underwent revascularization
- In-vitro hemolysis and its financial impact using different blood collection systems
- Leserbrief/Letter to the Editor
- Betreff Cadamuro et al.: In-vitro hemolysis and its financial impact using different blood collection systems
- Antwort auf A. von Meyer: Cadamuro et al. In-vitro Hämolyse verschiedener Blutabnahmesysteme sowie deren finanzielle Auswirkung
- Buchbesprechung/Book Review
- Pre-examination procedures in laboratory diagnostics

