Zusammenfassung
Die allergologische In-vitro-Diagnostik zeigt in den letzten Jahren vielfältige dynamische Entwicklungen und Fortschritte. Dies ist zum einen der Verfügbarkeit von sogenannten molekularen Komponenten der verschiedenen Allergene geschuldet, die heute eine komponentenbasierte Diagnostik erlauben. Diese ist zur Risikoabschätzung und Stratifizierung von Patienten sowie zur Auswahl der geeigneten (spezifischen) Immuntherapie essentiell. Darüber hinaus sind Fortschritte zu verzeichnen in der Differentialdiagnose von Nahrungsmittelunverträglichkeiten und –allergien. Die zelluläre Diagnostik ist ebenfalls auf dem Vormarsch, wie z.B. mit den basophilen Aktivierungstests. Die jüngsten Entwicklungen werden in diesem Artikel diskutiert.
Abstract
In vitro allergy diagnostics is rapidly advancing. This is primarily due to the development of component-based diagnostic tools. The availability of allergen components now allows a more precise and patient-tailored diagnostics, which has implications for therapeutic strategies including decision about specific immunotherapy. Furthermore, differential diagnostics of food intolerances and food allergies is also advancing because of this novel test. Another area of advancement is cellular diagnostics, which is primarily based on basophile activation tests. These recent developments will be discussed in this article.
Rezensierte Publikation:
Sack U. Conrad K.
Molekulare, komponentenbasierte Allergiediagnostik
Allergische Erkrankungen sind auf dem Vormarsch. Sie manifestieren sich an den Grenzflächen des Organismus zur Umwelt, also:
Haut (Neurodermitis, atopisches Ekzem),
obere Atemwege (allergische Rhinitis, „Heuschnupfen“),
untere Atemwege (Asthma),
Gastrointestinaltrakt (Nahrungsmittelallergien).
Im Mittelpunkt der Allergiediagnostik steht nach wie vor die Messung von Allergen-spezifischen IgE-Antikörpern. Diese Antikörper werden produziert auf der Basis einer komplexen Gen-Umwelt-Interaktion. Allergische Erkrankungen haben als komplexe, chronisch-inflammatorische Erkrankungen (wie andere chronische Entzündungserkrankungen auch) eine genetische Komponente. Es handelt sich hierbei um multigenetische Erkrankungen, bei denen Polymorphismen in einer Vielzahl von Genen nachgewiesen werden konnten. Die betroffenen Gene kodieren überwiegend für Moleküle des Immunsystems, Strukturelemente der betroffenen Organe, Barrierefunktionen etc. Jede Erkrankung und dann wiederum jeder Patient (inter-individuelle Heterogenität) zeigt hierbei ein eigenes genetisches Muster.
Basierend auf der Genetik bedarf es der Exposition zu bestimmten Umweltfaktoren, um die Erkrankung klinisch manifest zum Ausbruch zu bringen. Die westlich-industrialisierte Lebensweise scheint hier von besonderer Bedeutung zu sein. Faktoren aus diesem Milieu inkludieren Ernährung, Exposition zu Mikroben (“Hygiene-Hypothese”), Stressfaktoren und andere. Als Resultat dieser komplexen Gen-Umwelt-Interaktionen ist das Immunsystem des Patienten insofern fehlreguliert, als dass auf die Exposition mit harmlosen Umweltantigenen eine chronisch-inflammatorische Immunantwort initiiert und perpetuiert wird, in deren Mittelpunkt sogenannte TH2-T-Zellen stehen, die über ihre Zytokinproduktion dann die Effektorphase der allergischen Entzündung regulieren (Abbildung 1). Als eine wesentliche Konsequenz kommt es zur Produktion von (allergen-spezifischen) IgE-Antikörpern.
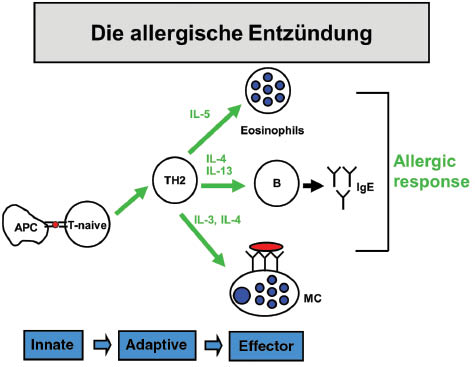
Regulation der allergischen Entzündungsantwort und Effektorantwort über die Bildung von TH2-T-Zellen, die ihrerseits die Eosinophilie, Mastzellaktivierung und IgE-Produktion im Rahmen der Entzündungsreaktion steuern.
Von großer Bedeutung ist die Differenzierung zwischen einer sogenannten Sensibilisierung und einer klinisch relevanten Allergie. Unter einer Sensibilisierung verstehen wir die Entwicklung einer spezifischen Immunantwort und IgE-Produktion auf ein Allergen. Es ist Aufgabe des Klinikers zu überprüfen, inwieweit die nachgewiesenen IgE-Antikörper auch für die klinischen Reaktionen des Patienten verantwortlich sind. Dies bedarf in der Regel weiterer diagnostischer Maßnahmen, wie z.B. einer Allergenprovokation am Endorgan, Eliminationsdiäten bei Verdacht auf Nahrungsmittelallergie etc. In keinem Fall wird über den alleinigen Nachweis von spezifischem IgE die Diagnose einer Allergie gestellt!
Für den Nachweis spezifischer IgE-Antikörper stehen verschiedene Testverfahren zur Verfügung. Im Wesentlichen unterscheiden sich heute diese Testverfahren darin, ob die Allergene trägergebunden oder in flüssiger Form im Testsystem vorliegen. Für beide Ansätze stehen kommerzielle Testsysteme zur Verfügung.
Des Weiteren muss unterschieden werden zwischen Tests mit Einzelallergenen und Tests mit Allergengemischen. Bei den Einzelallergenen gilt es dann wiederum zu unterscheiden zwischen nativen Allergenen, die im Testsystem eingesetzt werden. Hierbei handelt es sich in der Regel um Proteingemische, die mehr oder weniger gut charakterisiert und aufgereinigt sind, und dem Einsatz von Einzelkomponenten dieser Allergene. Solche Komponenten können aufgereinigt sein (dann enthalten sie auch den Kohlehydratanteil) oder sie sind in rekombinanter Form hergestellt (dann enthalten sie diesen Kohlehydratanteil nicht).
Im Zeitalter der molekularen Allergologie ist es in den letzten zwei Dekaden gelungen, die Allergene auf molekularer und genetischer Ebene weitestgehend zu charakterisieren (zumindest die wichtigsten Allergene betreffend). Hierbei ist zunächst klar geworden, dass einzelne Allergene, wie z.B. Birkenpollen, Haselnuss, Erdnuss, Milbe oder Gräserpollen, jeweils Allergengemische darstellen. Sie setzen sich aus einer unterschiedlichen Anzahl von Proteinkomponenten zusammen. Diese Komponenten haben eine mehr oder weniger große Bedeutung für die Auslösung allergischer Reaktionen.
Wir sprechen von Major-Allergenen, wenn mindestens 50% der entsprechend erkrankten Patienten auf diese Komponente reagieren (z.B. Bet v 1). Dem gegenüber stehen Minor-Allergene. Minor-Allergene sind Komponenten, bei denen weniger als 15% der Patienten eine klinische Reaktion zeigen. Dennoch kann diese klinische Reaktion durchaus heftiger Natur sein (z.B. Bet v 2).
Bei vielen dieser einzelnen Komponenten finden sich phylogenetische Verwandtschaften untereinander. Solche Komponenten, die einer Proteinfamilie zugeordnet werden können und mit hoher Homologie bei verschiedenen Allergenquellen nachgewiesen werden können, sind dann verantwortlich für klinisch-relevante Kreuzreaktionen. Dem gegenüber gibt es auch allergenspezifische Komponenten. Wenn hier eine Sensibilisierung nachgewiesen wird, ist dies eine für dieses jeweilige Allergen spezifische Reaktion.
In Tabelle 1 sind wichtige und klinisch relevante Proteinfamilien zusammengestellt, auf die nun im Einzelnen exemplarisch an ausgewählten Beispielen näher eingegangen werden soll [1, 2].
Wichtige und klinisch relevante Proteinfamilien.
| – Profiline |
| – PR-10 |
| – Lipid transfer protein |
| – Speicherproteine |
| – Tropomyosenie |
| – Parvalbumine |
Profiline
Profiline sind weit verbreitet im Pflanzenreich. Sensibilisierungen finden sich häufig, allerdings äußerst selten mit klinischer Relevanz. Prominente Beispiele sind das Birkenpollen-Allergen Bet v 2 oder das Latex-Allergen Hev b 8 [1].
Speicherproteine
Am anderen Spektrum der klinischen Relevanz befinden sich die Speicherproteine. Dieses sind Hauptallergene bei Leguminosen, Samen und anderen Pflanzen. Sie machen häufig den größten Proteinanteil bei diesen Allergenen aus. Sie sind hitzestabil und deswegen auch im gekochten Zustand reaktiv. Ferner sind sie häufig resistent gegenüber enzymatischer Degradation, und es kommt bereits zur Reaktion bei niedrigen Expositionsdosen. Die häufigste und wichtigste Gruppe sind die 2S-Albumine.
Hieraus wird bereits deutlich, dass sich die Speicherproteine in mehrere Unterfamilien gliedern lassen, nämlich die 2S-, die 7S- und die 11S-Globuline. Tabelle 2 fasst den aktuellen Stand der Kenntnisse und Verteilung bei verschiedenen Allergenen zusammen:
Wichtige Speicherproteine.
| 2S-Albumine | 7S-Globuline | 11S-Globuline | |
|---|---|---|---|
| Erdnuss (Arachis hypogaea) | Ara h 2 | Ara h 1 | Ara h 3 |
| Ara h 6 | Ara h 4 | ||
| Soja (Glycine max) | Gly m 5 | Gly m 6 | |
| Haselnuss (Corylus avellana) | Cor a 14 | Cor a 11 | Cor a 9 |
| Walnuss (Juglans regia) | Jug r 1 | Jug r 2 | Jug r 4 |
| Paranuss (Bertolletia excelsa) | Ber e 1 | ||
| Buchweizen (Fagopyrum esculentum) | Fag e 2 | ||
| Sesam (Sesamum indicum) | Ses i 1 |
Ein wichtiges Beispiel für die klinische Relevanz ist die Erdnuss [3–9]. Die Erdnuss besteht aus einer größeren Zahl an Komponenten, die jeweils verschiedenen Proteinfamilien angehören. Ara h 1, Ara h 2, Ara h 3, Ara h 4 und Ara h 6 sind Mitglieder der Speicherproteine.
Welches diagnostische Vorgehen hat sich in jüngster Zeit etablieren können?
Zunächst ist deutlich geworden, dass der Nachweis von IgE-Reaktivität bei den Speicherproteinen von hoher diagnostischer Bedeutung ist. Insbesondere der Komponente Ara h 2 wird hier große Bedeutung beigemessen. Von weiterem Interesse ist die isolierte Positivität auf Ara h 8 (AMPR10-Protein). Dieses scheint isoliert betrachtet mit einer Toleranz gegenüber Erdnuss assoziiert zu sein. Ein diagnostischer Algorithmus wurde von Dang et al. [3] vorgeschlagen.
In einer weiteren Studie sind über 200 Kinder evaluiert worden, von denen die Hälfte im Rahmen von doppelblind-placebokontrollierten Nahrungsmittelprovokationen positiv getestet worden sind auf Erdnussallergie, und die andere Hälfte Erdnuss-tolerant war. Die beste diagnostische Sensitivität und Spezifität wurde erreicht mit folgendem diagnostischem Algorithmus:
Zunächst Testung mit einem Erdnuss-Extrakt. Wenn das IgE beim Erdnuss-Extrakt größer 15 kU/l ist, dann
Testung mit rekombinanten Ara h 2. Ist dieses positiv, kann die Diagnose einer Erdnussallergie gestellt werden, ohne dass eine Provokation notwendig ist. Mit diesem diagnostischen Algorithmus erspart man sich – zumindest in dieser Studie – 2/3 der notwendigen Provokationen.
Sojaallergie
Ein weiteres wichtiges, klinisch-relevantes Beispiel für die Relevanz von Speicherproteinen ist die Sojaallergie [10, 11]. Hier spielen die Komponenten Gly m 4, Gly m 5 und Gly m 6 eine wichtige Rolle, wobei Gly m 5 und Gly m 6 Speicherproteine darstellen. Gly m 4-Sensibilisierungen finden sich vor allem im Rahmen von Kreuzreaktivitäten zwischen Pollen und Soja. Dies ist zurückzuführen auf Kreuzreaktivitäten mit Bet v 1 (einem PR10-Protein).
Gly m 5 und Gly m 6 haben einen hohen positiven prediktiven Wert bei der Diagnose einer Sojaallergie.
Hieraus hat sich jetzt folgende Kartierung für die klinische Bedeutung von Sojaallergenkomponenten heraus kristallisiert (Abbildung 2):
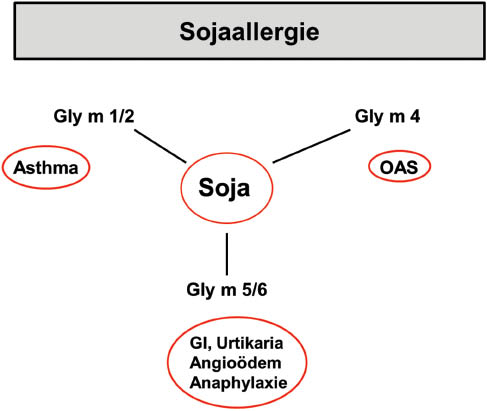
Rolle der Komponenten Gly m 4, Gly m 5 und Gly m 6 im Rahmen der Soja-allergiediagnostik.
Gly m 5 und Gly m 6: Insbesondere schwere Reaktionen im Gastrointestinaltrakt, aber auch Urtikaria, Angioödem und Anaphylaxie,
Gly m 4 als PR10-Protein im Rahmen des oralen Allergie-Syndroms bei Kreuzreaktionen zwischen Pollen und Nahrungsmitteln,
Gly m1 und Gly m 2: Mögliche Bedeutung beim Asthma bronchiale als inhalatives Allergen.
Haselnussallergie
Auch im Rahmen der Diagnostik der Haselnuss-Allergie sind Fortschritte erzielt worden [12, 13]. Die Komponenten Cor a 9 und Cor a 14 gehören zu den Speicherproteinen und sind eng assoziiert mit schweren Reaktionen und einer echten primären Haselnussallergie. Dem gegenüber ist die Komponente Cor a 1 ein PR10-Protein und eng verwandt mit dem Birkenpollen-Allergen Bet v 1 und somit von Bedeutung beim oralen Allergiesyndrom (Kreuzreaktion zwischen Pollen und Nahrungsmitteln). Eine Sensibilisierung auf Cor a 8 wird selten beobachtet.
Die Familie der PR10-Proteine (Pathogenese-related proteins)
PR10-Proteine kommen ebenfalls sehr häufig in der Natur vor. Sie sind im Unterschied zu den Speicherproteinen hitzesensitiv, werden also in der Regel in gekochtem oder gebackenem Zustand toleriert. Häufig sind diese Sensibilisierungen assoziiert mit dem oralen Allergiesyndrom, also mit milden lokalen Reaktionen, wie wir sie häufig finden bei Früchte-Gemüse-Pollen-Syndromen, insbesondere in Mittel- und Nordeuropa. Abbildung 3 fasst dieses noch einmal tabellarisch zusammen.
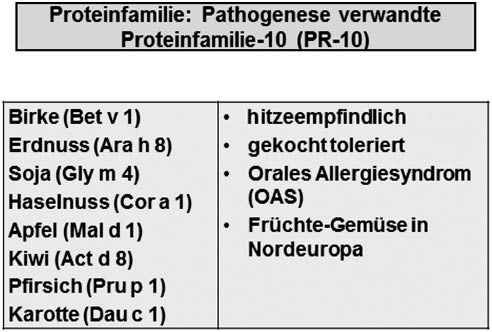
Wichtige Eigenschaften und Beispiele der PR10-Proteinfamilie.
Die Problematik der kreuzreagierenden Kohlehydrat-Determinanten (CCD; Cross reactive carbohydrate determinants)
Allergene und Allergenkomponenten im nativen Zustand sind in der Regel glykosilierte Proteine. An diesen Proteinen hängen kurze Zuckerketten. Solche kurzen Zuckerketten enthalten häufig nur ein IgE-Bindungsepitop. Bei einem Patienten, der gegen diese CCD-Determinanten IgE-Antikörper bildet, binden diese IgE-Antikörper zwar im in-vitro-assay-System, in der biologischen Realität kommt es aber nicht zu einer Kreuzvernetzung auf der Oberfläche von IgE-Rezeptor-tragenden Effektorzellen (z.B. Mastzellen und basophile Granulozyten), also auch nicht zu einer Aktivierung und Mediatorausschüttung aus diesen Zellen. Daher ist die klinische Relevanz ausgesprochen gering und nur sehr selten finden sich klinische Symptome bei solchen IgE-Positivitäten.
Beispiele hierzu sind das Bromelain, welches z.B. in der Ananas und in anderen Früchten vorkommt, und die Meerrettich-Peroxidase. Mittlerweile stehen kommerzielle Testsysteme zur Verfügung, um IgE-Antikörper gegen CCD-Determinanten zu detektieren.
Von Bedeutung ist die Diagnostik von CCD-IgE z.B. bei der Bienen- und Wespengiftallergie [14–18]. Hierbei können zwei unterschiedliche diagnostische Algorithmen differenziert werden:
Entweder zunächst Testung mit nativem Bienen- und Wespengiftextrakt. Fällt die Testung auf einen von beiden Extrakten positiv aus, so kann von einer spezifischen Sensibilisierung ausgegangen werden. Sind hingegen beide Tests positiv, stellt sich die Frage, ob der Patient eine echte Doppelsensibilisierung auf Biene und Wespe aufweist oder ob es sich bei dem Patienten um eine unspezifische Reaktion handelt (auf CCD-Epitope). Die in den nativen Giften enthaltenen Proteine tragen nämlich genau solche CCD-relevanten Zuckerseitenketten. Hier wird dann im zweiten Schritt auf CCD-IgE getestet, um zwischen der Kreuzreaktivität (unspezifische Sensibilisierung) bzw. der echten Kreuzsensibilisierung zu differenzieren.
Alternativ kann heute auch gleich mit rekombinanten Allergenen getestet werden, die genau diese Zuckerseitenketten nicht tragen. Der entsprechende diagnostische Algorithmus ist dargestellt.
Wichtig ist in dem Zusammenhang auch, dass gerade bei Wespenallergie die Testung mit Extrakten nicht alle Allergiker erfasst. Dies konnte jüngst in einer Publikation herausgearbeitet werden. Erst unter zusätzlichem Einsatz von rekombinanten Ves v 5 ist es gelungen, die nach Extrakt-Testung negativ ausgefallene Population weiter zu diskriminieren. Der Grund hierfür ist wahrscheinlich, dass die Komponente Ves v 5 in nur sehr geringer Konzentration im natürlichen Extrakt enthalten ist. Von daher stellt sich die Frage, ob der natürliche Extrakt nicht mit rekombinanten Ves v 5 gespiked werden kann.
Dieses spielt eine Rolle bei bestimmten Allergien auf rotes Fleisch. Es konnte gezeigt werden, dass nach Zeckenbissen IgE-Antikörper gegen alpha-GAL (Galactose-alpha-1,3-Galactose) nachgewiesen werden können. Alpha-GAL findet sich im Gastrointestinaltrakt der Zecke. Alpha-GAL ist aber auch Bestandteil der Gelatine (aus Rinderkollagen gewonnen). Patienten, die auf Gelatine allergisch reagieren, reagieren in der Regel auch auf rotes Fleisch, wenn die Gelatineallergie auf alpha-GAL zurückzuführen ist. Dieser Zusammenhang scheint zunehmend von klinischer Bedeutung zu sein [19, 20].
Die Proteinfamilie der Tropomyosine
Tropomyosine sind Aktin-bindende Proteine, die vor allen Dingen in Muskelzellen vorkommen. Hier bestehen Kreuzreaktivitäten zwischen Hausstaubmilben, Krusten- und Schalentieren (Abbildung 4).
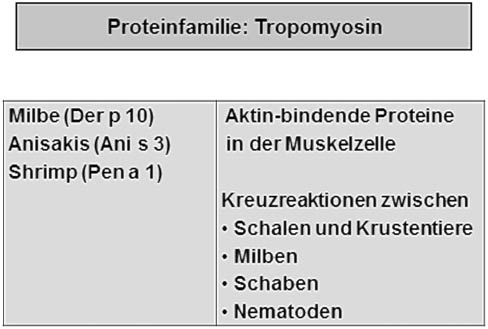
Die Proteinfamilie der Tropomyosine – Eigenschaften und Vorkommen.
Dies ist deswegen von besonderer Relevanz, weil eine Untergruppe der Patienten mit Hausstaubmilbenallergie auch auf die Komponente Der p 10 mit IgE reagiert. Dieses Der p 10 ist das Tropomyosin der Milbe und verantwortlich für häufig schwere klinische Reaktionen von Milbenallergikern auf Krusten- und Schalentiere.
Tierallergene
Sensibilisierung und Allergien gegen Tiere kommen zunehmend häufiger vor [21]. Prominente Beispiele sind die Katzenallergie (hier ist es das Sekretoglobulin Fel d 1 aus dem Speichel der Katze), aber auch Hunde- und Pferdeallergien. Bei Berufs-Exponierten spielt auch eine Allergie auf Mäuse (und Ratten) eine Rolle (Tierpfleger etc.). Hierbei sind es häufig die Lipocaline, die verantwortlich sind für die entsprechenden Reaktivitäten.
Die klinische Relevanz solcher Sensibilisierungen ist insbesondere bei Patienten mit Asthma hinlänglich bekannt. Dies liegt daran, dass Tierallergene häufig inhalativ zur Exposition gelangen. In einer aktuellen Studie wurde dies untersucht an Schulkindern mit schwerem Asthma. Hier konnte gezeigt werden, dass Kinder mit Multi-Sensibilisierungen gegen Tierproteine mit einer schwereren Verlaufsform assoziiert sind, als oligosensibilisierte oder gar nicht gegen Tierhaar sensibilisierte Kinder (Tabelle 3).
Allergene der Haustiere.
| Lipocalcine | Can g 1,2 | (Hund) |
| Fel d 4 | (Katze) | |
| Equ c 1 | (Pferd) | |
| Mus m 1 | (Maus) | |
| Secretoglobine | Fel d 1 | (Katze) |
| Kallikreine | Can g 5 | (Hund) |
Nahrungsmittelunverträglichkeit – Nahrungsmittelallergie
Klinische Reaktionen auf Nahrungsmittel sind ein häufiges klinisches Problem. Verschiedene pathogenetische Mechanismen und Prinzipien können hier ursächlich verantwortlich sein. In aktuellen differentialdiagnostischen Algorithmen wird unterschieden zwischen immunologischen und nicht-immunologischen Reaktionen. Nicht-immunologische Reaktionen sind z.B. Enzymdefekte im Lactase-Gen, die zu einer Lactose-Unverträglichkeit führen.
Immunologische Reaktionen können allergischer oder nicht-allergischer Genese sein. Nicht-allergische Reaktionen sind z.B. Autoimmunreaktionen wie wir sie bei der Zöliakie gegen Gluten kennen.
In diesem Zusammenhang spielen dann auch Komponenten des Weizens eine wichtige Rolle [22, 23]. In jüngster Zeit ist in diesem Kontext ein neues Syndrom beschrieben worden, welches als WDEIA (wheat-dependent exercise-induced anaphylaxis) bezeichnet wird. Hierunter verbirgt sich das weizenabhängige bewegungsinduzierte Anaphylaxie-Syndrom. Dieses findet sich bei Patienten, die eine Anaphylaxie entwickeln, wenn eine zeitliche Nähe zwischen dem Konsum von weizenhaltigen Nahrungsmitteln und körperlicher Anstrengung besteht. Nur in diesem zeitlichen Kontext betrachtet ist dann die Omega-5-Gliadin-IgE-Reaktivität von klinischer Relevanz. Wie dies pathogenetisch zu erklären ist, bleibt nach wie vor offen und ist Gegenstand weiterer Studien. Allerdings scheint das WDEIA-Syndrom in unseren Breiten zuzunehmen. Zugrunde liegt eine IgE-Reaktivität gegen Omega-5-Gliadin (Tri a 19).
Im Unterschied hierzu spielen IgE-Reaktivitäten gegen Tri a 27 und 28 eine Rolle bei Mehlstaubinhalation, wie wir es beim sogenannten “Bäcker-Asthma” als Berufserkrankung kennen.
Weitere Informationen zu den Details der Biochemie, Pathophysiologie und klinischen Relevanz verschiedener Allergenkomponenten – auch seltene Allergene – finden sich in einem kürzlich publizierten Konsensuspapier, welches unter der Schirmherrschaft der World Allergy Association (WAO) erschienen ist und als Open Access Document bezogen werden kann.
Hieraus abgeleitet wird eine „Hitliste“ der wichtigsten komponentenbasierten Allergene, die mit einem schweren klinischen Verlauf und hohem Risikopotential assoziiert sind.
Der Allergie-Protein-Array
Zunehmende Verbreitung findet ein Allergen-Mikrochip, der das umfänglichste Spektrum an Allergenkomponenten abgreift. Hierbei handelt es sich um den Einzug der Protein-Array-Diagnostik in den Alltag der Labormedizin. Auf diesem Array in seiner aktuellsten Version sind 112 Komponenten von 51 verschiedenen Allergenquellen aufgetragen. Jede dieser Komponenten wird in einer Dreifachbestimmung analysiert, um die Qualität der erzeugten Resultate zu optimieren. Ferner gibt es Positivkontrollen und Standards. Ausgewiesen wird das Ergebnis in semiquantitativer Form in sogenannten ISU (International Standardized Units). Diese Einheiten sind allerdings nicht identisch mit den an einem WHO-Standard kalibrierten International Units, die heute in der routinemäßigen Einzel-Komponenten-Analytik Verwendung finden. Allerdings konnte gezeigt werden, dass für viele – aber bei weitem nicht alle! – Komponenten eine enge Korrelation zwischen ISU und IU besteht. Abweichungen finden sich allerdings insbesondere im niedrigen Konzentrationsbereich von spezifischen IgE-Antikörpern. Bei Sensibilisierungen ≤1 IU spezifisches IgE finden sich am häufigsten diskrepante Resultate.
Dennoch hilft dieser Protein-Array gerade bei Patienten mit schwierigen Verläufen, vielfältigen Sensibilisierungen (sogenannte „polysensibilisierte Patienten“) und in anderen Spezialfällen der allergologischen Abklärung. Unter Einsatz einer solchen Multi-Parameter-Analytik werden zunehmend neue Erkenntnisse über die Ontogenese der allergischen Sensibilisierung bei Patienten gewonnen. So konnte in mehreren Studien jetzt gezeigt werden, dass IgE-Antikörper gegen bestimmte einzelne Komponenten z.T. Jahre vor Ausbruch der klinisch-manifesten Allergie nachgewiesen werden. In einer italienischen Studie im Rahmen einer retrospektiven Analyse konnte nachgewiesen werden, dass Gräserpollenallergiker Jahre vor Ausbruch der klinischen Symptomatik insbesondere Sensibilisierungen gegen Phl p 1, Phl p 2 und Phl p 4 aufweisen. Dies deckt sich mit einer anderen Untersuchung, bei der mittlerweile Daten über 18 Lebensjahre vorliegen (hier ebenfalls eine retrospektive Analyse). Hier finden sich IgE-Reaktivitäten vor Ausbruch der Erkrankung insbesondere bei Pollen, Tierhaaren, Erdnuss, Soja und Fischen.
Zelluläre Tests
Zelluläre Testungen spielen im Rahmen der (erweiterten) Allergiediagnostik eine zunehmende Rolle. Zum einen bei Patienten mit diskrepanten Ergebnissen zwischen Anamnese, Hauttest und spezifischer IgE-Diagnostik, zum anderen bei Patienten mit besonderen Fragestellungen, wie z.B. Medikamentenunverträglichkeiten und Medikamentenallergien. Aber auch wenn es um exotische Allergene geht, die in dem regulären Panel der in-vitro Diagnostik nicht verfügbar sind, bieten zelluläre Testsysteme eine probate Alternative.
Historisch betrachtet ist die Histaminmessung bzw. die Histaminfreisetzung nach Stimulation von Effektorzellen ein erster Ansatz hin zu einer zellulären Routineanalytik gewesen. Die Messung des Histamins bzw. seiner Abbauprodukte stellt allerdings eine analytische Herausforderung dar, bedingt durch niedrige Konzentrationen und schnelle Verstoffwechselung.
Ein Fortschritt sind die Leukotrien-Freisetzungs-Assays. Diese Tests sind im Prinzip in einem 2-Stufen-System aufgebaut. In einem ersten Schritt werden Zellen des Patienten mit den entsprechenden Allergenen oder Medikamenten inkubiert. In einer zweiten Stufe schließt sich dann die Messung des Mediators mittels (manueller und aufwändiger) ELISA-Technik an.
Eine Alternative stellen nun die durchflusszytometrischen Untersuchungen dar [24–39].
Im Mittelpunkt des Interesses stehen die basophilen Granulozyten. Basophile Granulozyten exprimieren den hoch affinen IgE-Rezeptor (genauso wie Mastzellen), können also über die IgE-vermittelte Kreuzvernetzung zur Mediatordegranulation gebracht werden. Gleichzeitig können diese Zellen auch über nicht-IgE-vermittelte Mechanismen zur Degranulation und Mediatorausschüttung gebracht werden (Bindung von C5a, FNLP-vermittelte Aktivierung etc.). Damit verhalten sich basophile Granulozyten, zumindest in Bezug auf diese Aspekte, sehr ähnlich wie Mastzellen als wichtige Effektoren der allergischen Reaktion. Eingesetzt wird heute Vollblut des Patienten (50 μL reichen pro Testansatz aus). Eine weitere Anreicherung der Zellen ist nicht erforderlich, da nachher die Basophilen durch entsprechende Marker auf der Oberfläche durchflusszytometrisch identifiziert werden können. Hierbei können die Zellen identifiziert werden über die Expression von CD123 (dem IL-3 Rezeptor) sowie der charakteristischen Positionierung im Vorwärts- und Seitwärts-Scatter. Des Weiteren können Antikörper gegen CCR3 ebenfalls herangezogen werden anstelle von CD123.
Als Ausdruck der Aktivierung wird die Expression von CD63 gemessen. CD63 ist physiologischerweise intrazellulär lokalisiert und wird erst nach Aktivierung/Degranulation auf der Oberfläche exprimiert. In den meisten Fällen korreliert die Expression von CD63 mit der Histaminfreisetzung [24]. Neben einer kleinen Basal-Expression von CD63 findet sich manchmal eine bimodale Kurve nach Aktivierung. Dies deutet darauf hin, dass bei diesem Patienten zwei Populationen an Mastzellen im peripheren Blut vorhanden sind, nämlich Zellen, die besonders stark reagieren und dann eine sehr hohe CD63 Expression aufweisen, und eine zweite Population mit schwacher Reagibilität. Dies ist allerdings für die klinische Interpretation des Testergebnisses nur von nachgeordneter Bedeutung, weil diese Tests vor allen Dingen dazu dienen, zu prüfen ob das entsprechende Allergen/Antigen überhaupt zu einer Aktivierung der Zellen führt.
Um die Basophilenaktivierung richtig in Schwung zu bringen, bedarf es der zusätzlichen Exposition mit IL-3. In den kommerziellen Assays ist daher IL-3 entsprechend mitgeliefert. IL-3 führt aber auch zur Heraufregulation von CD69 und von CD203c. Sollte der Patient also auf seinen Basophilen bereits erhöhte Expressionen an CD69 und/oder CD203c zeigen, spricht dies für eine vorangegangene in-vivo Exposition zu IL-3 (häufig assoziiert mit einer vorangegangenen Mastzell-/Basophilenaktivierung).
Der Basophilenaktivierungstest (BAT) wird vielfältig eingesetzt, sowohl im Forschungs- als auch im Routinelabor [25–38].
Ein wesentlicher Anwendungspunkt ist die Fragestellung der Medikamentenallergie/-unverträglichkeit. Hier können im klinischen Routinealltag 3 wesentliche Medikamentengruppen voneinander unterschieden werden (Abbildung 4):
Die Betalactam-Antibiotika
Dies sind die einzigen Medikamente, bei denen IgE-Antikörper häufig nachgewiesen werden können. Bei diskrepanten Resultaten zwischen Hauttest, IgE und Anamnese würde man dann in einer zweiten Stufe den BAT durchführen.
Neuromuskuläre Blocker aus der Anästhesie
Hier werden in der Regel keine IgE-Antikörper gefunden. Der Hauttest mit den entsprechenden Medikamenten ist in der Diagnostik die Testung der Wahl. Sollten auch hier wiederum diskrepante Untersuchungen zwischen Hauttest, Anamnese und klinischer Exposition nachgewiesen werden, so kommt in einer zweiten Stufe der BAT zur Anwendung.
Die nicht-steroidalen Antiphlogistika (NSAID)
Hier spielen nur Hauttest und Provokation eine Rolle, IgE-Diagnostik ist negativ und häufig frustran, ebenso der BAT.
Interessenkonflikt:Der Autor erklärt, dass keine wirtschaftlichen oder persönlichen Interessenkonflikte bestehen.
Literatur
1. Hauser M, Roulias A, Ferreira F, Egger M. Panallergens and their impact on the allergic patient. Allergy Asthma Clin Immunol 2010;6:1–14.10.1186/1710-1492-6-1Search in Google Scholar PubMed PubMed Central
2. Experten-Workshop “Allergie: Diagnostik & Therapie”. 22.-23. April 2012, Hamburg.Search in Google Scholar
3. Dang TD, Tang M, Choo S, Licciardi PV, Koplin JJ, Martin PE, et al. Increasing the accuracy of peanut allergy diagnosis by using Ara h 2. J Allergy Clin Immunol 2012;129:1056–63.10.1016/j.jaci.2012.01.056Search in Google Scholar PubMed
4. Bublin M, Kostadinova M, Radauer C, Hafner C, Szepfalusi Z, Varga EM, et al. IgE cross-reactivity between the major peanut allergen Ara h 2 and the nonhomologous allergens Ara h 1 and Ara h 3. J Allergy Clin Immunol 2013;132:118–24.10.1016/j.jaci.2013.01.022Search in Google Scholar PubMed
5. Codreanu F, Collignon O, Roitel O, Thouvenot B, Sauvage C, Vilain AC, et al. A novel immunoassay using recombinant allergens simplifies peanut allergy diagnosis. Int Arch Allergy Immunol 2011;154:216–26.10.1159/000321108Search in Google Scholar PubMed
6. Nicolaou N, Poorafshar M, Murray C, Simpson A, Winell H, Kerry G, et al. Allergy or tolerance in children sensitized to peanut: prevalence and differentiation using component-resolved diagnostics. J Allergy Clin Immunol 2010;125:191–7.10.1016/j.jaci.2009.10.008Search in Google Scholar PubMed
7. Asarnoj A, Moverare R, Ostblom E, Poorafshar M, Lilja G, Hedlin G, et al. IgE to peanut allergen components: relation to peanut symptoms and pollen sensitization in 8-year-olds. Allergy 2010;65:1189–95.10.1111/j.1398-9995.2010.02334.xSearch in Google Scholar PubMed
8. Lopes de Oliveira LC, Aderhold M, Brill M, Schulz G, Rolinck-Werninghaus C, Clare Mills EN, et al. The value of specific IgE to peanut and its component Ara h 2 in the diagnosis of peanut allergy. J Allergy Clin Immunol Pract 2013;1:394–8.10.1016/j.jaip.2013.05.010Search in Google Scholar PubMed
9. Asarnoj A, Nilsson C, Lidholm J, Glaumann S, Ostblom E, Hedlin G, et al. Peanut component Ara h 8 sensitization and tolerance to peanut. J Allergy Clin Immunol 2012;130:468–72.10.1016/j.jaci.2012.05.019Search in Google Scholar PubMed
10. Ito K, Sjolander S, Sato S, Moverare R, Tanaka A, Soderstrom L, et al. IgE to Gly m 5 and Gly m 6 is associated with severe allergic reactions to soybean in Japanese children. J Allergy Clin Immunol 2011;128:673–5.10.1016/j.jaci.2011.04.025Search in Google Scholar PubMed
11. Kosma P, Sjolander S, Landgren E, Borres MP, Hedlin G. Severe reactions after the intake of soy drink in birch pollen-allergic children sensitized to Gly m 4. Acta Paediatr 2011;100:305–6.10.1111/j.1651-2227.2010.02049.xSearch in Google Scholar PubMed
12. Masthoff LJ, Mattsson L, Zuidmeer-Jongejan L, Lidholm J, Andersson K, Akkerdaas JH, et al. Sensitization to Cor a 9 and Cor a 14 is highly specific for a hazelnut allergy with objective symptoms in Dutch children and adults. J Allergy Clin Immunol 2013;132:393–9.10.1016/j.jaci.2013.02.024Search in Google Scholar PubMed
13. Hofmann C, Scheurer S, Rost K, Graulich E, Jamin A, Foetisch K, et al. Cor a 1-reactive T cells and IgE are predominantly cross-reactive to Bet v 1 in patients with birch pollen-associated food allergy to hazelnut. J Allergy Clin Immunol 2013;131:1384–92.10.1016/j.jaci.2012.10.037Search in Google Scholar PubMed
14. Vos B, Kohler J, Muller S, Stretz E, Rueff F, Jakob T. Spiking venom with rVes v 5 improves sensitivity of IgE detection in patients with allergy to Vespula venom. J Allergy Clin Immunol 2013;131:1225–7.10.1016/j.jaci.2012.07.041Search in Google Scholar PubMed
15. Sturm GJ, Hemmer W, Hawranek T, Lang R, Ollert M, Spillner E, et al. Detection of IgE to recombinant Api m 1 and rVes v 5 is valuable but not sufficient to distinguish bee from wasp venom allergy. J Allergy Clin Immunol 2011;128:247–8.10.1016/j.jaci.2011.02.021Search in Google Scholar PubMed
16. Seismann H, Blank S, Cifuentes L, Braren I, Bredehorst R, Grunwald T, et al. Recombinant phospholipase A1 (Ves v 1) from yellow jacket venom for improved diagnosis of hymenoptera venom hypersensitivity. Clin Mol Allergy 2010;8:7.10.1186/1476-7961-8-7Search in Google Scholar PubMed PubMed Central
17. Jin C, Focke M, Leonard R, Jarisch R, Altmann F, Hemmer W. Reassessing the role of hyaluronidase in yellow jacket venom allergy. J Allergy Clin Immunol 2010;125:184–90.10.1016/j.jaci.2009.08.037Search in Google Scholar PubMed
18. Mittermann I, Zidarn M, Silar M, Markovic-Housley Z, Aberer W, Korosec P, et al. Recombinant allergen-based IgE testing to distinguish bee and wasp allergy. J Allergy Clin Immunol 2010;125:1300–7.10.1016/j.jaci.2010.03.017Search in Google Scholar PubMed
19. Hamsten C, Tran TA, Starkhammar M, Brauner A, Commins SP, Platts-Mills TA, et al. Red meat allergy in Sweden: association with tick sensitization and B-negative blood groups. J Allergy Clin Immunol 2013;132:1431–4.10.1016/j.jaci.2013.07.050Search in Google Scholar PubMed PubMed Central
20. Mullins RJ, James H, Platts-Mills TA, Commins S. Relationship between red meat allergy and sensitization to gelatin and galactose-alpha-1,3-galactose. J Allergy Clin Immunol 2012;129:1334–42.10.1016/j.jaci.2012.02.038Search in Google Scholar PubMed PubMed Central
21. Nordlund B, Konradsen JR, Kull I, Borres MP, Onell A, Hedlin G, et al. IgE antibodies to animal-derived lipocalin, kallikrein and secretoglobin are markers of bronchial inflammation in severe childhood asthma. Allergy 2012;67:661–9.10.1111/j.1398-9995.2012.02797.xSearch in Google Scholar PubMed
22. Ebisawa M, Shibata R, Sato S, Borres MP, Ito K. Clinical utility of IgE antibodies to omega-5 gliadin in the diagnosis of wheat allergy: a pediatric multicenter challenge study. Int Arch Allergy Immunol 2012;158:71–6.10.1159/000330661Search in Google Scholar PubMed
23. Hofmann SC, Fischer J, Eriksson C, Bengtsson GO, Biedermann T, Jakob T. IgE detection to alpha/beta/gamma-gliadin and its clinical relevance in wheat-dependent exercise-induced anaphylaxis. Allergy 2012;67:1457–60.10.1111/all.12020Search in Google Scholar PubMed
24. MacGlashan D, Jr. Expression of CD203c and CD63 in human basophils: relationship to differential regulation of piecemeal and anaphylactic degranulation processes. Clin Exp Allergy 2010;40:1365–77.10.1111/j.1365-2222.2010.03572.xSearch in Google Scholar PubMed PubMed Central
25. De Weck AL, Sanz ML, Gamboa PM, Aberer W, Bienvenu J, Blanca M, et al. Diagnostic tests based on human basophils: more potentials and perspectives than pitfalls. Int Arch Allergy Immunol 2008;146:177–89.10.1159/000115885Search in Google Scholar PubMed
26. Sudheer PS, Hall JE, Read GF, Rowbottom AW, Williams PE. Flow cytometric investigation of peri-anaesthetic anaphylaxis using CD63 and CD203c. Anaesthesia 2005;60:251–6.10.1111/j.1365-2044.2004.04086.xSearch in Google Scholar PubMed
27. Sonneck K, Baumgartner C, Rebuzzi L, Marth K, Chen KW, Hauswirth AW, et al. Recombinant allergens promote expression of aminopeptidase-n (CD13) on basophils in allergic patients. Int J Immunopathol Pharmacol 2008;21:11–21.10.1177/039463200802100103Search in Google Scholar PubMed
28. Hennersdorf F, Florian S, Jakob A, Baumgartner K, Sonneck K, Nordheim A, et al. Identification of CD13, CD107a, and CD164 as novel basophil-activation markers and dissection of two response patterns in time kinetics of IgE-dependent upregulation. Cell Res 2005;15:325–35.10.1038/sj.cr.7290301Search in Google Scholar PubMed
29. Aerts NE, Dombrecht EJ, Bridts CH, Hagendorens MM, de Clerck LS, Stevens WJ, et al. Simultaneous flow cytometric detection of basophil activation marker CD63 and intracellular phosphorylated p38 mitogen-activated protein kinase in birch pollen allergy. Cytometry B Clin Cytom 2009;76:8–17.10.1002/cyto.b.20437Search in Google Scholar PubMed
30. Apostolou E, Deckert K, Puy R, Sandrini A, de Leon MP, Douglass JA, et al. Anaphylaxis to Gelofusine confirmed by in vitro basophil activation test: a case series. Anaesthesia 2006;61:264–8.10.1111/j.1365-2044.2005.04529.xSearch in Google Scholar PubMed
31. Lourenco FD, Azor MH, Santos JC, Prearo E, Maruta CW, Rivitti EA, et al. Activated status of basophils in chronic urticaria leads to interleukin-3 hyper-responsiveness and enhancement of histamine release induced by anti-IgE stimulus. Br J Dermatol 2008;158:979–86.10.1111/j.1365-2133.2008.08499.xSearch in Google Scholar PubMed
32. Chirumbolo S, Vella A, Ortolani R, De Gironcoli M, Solero P, Tridente G, et al. Differential response of human basophil activation markers: a multi-parameter flow cytometry approach. Clin Mol Allergy 2008;6:12.10.1186/1476-7961-6-12Search in Google Scholar PubMed PubMed Central
33. Nagao M, Hiraguchi Y, Hosoki K, Tokuda R, Usui T, Masuda S, et al. Allergen-induced basophil CD203c expression as a biomarker for rush immunotherapy in patients with Japanese cedar pollinosis. Int Arch Allergy Immunol 2008;146 (Suppl 1):47–53.10.1159/000126061Search in Google Scholar PubMed
34. Buhring HJ, Streble A, Valent P. The basophil-specific ectoenzyme E-NPP3 (CD203c) as a marker for cell activation and allergy diagnosis. Int Arch Allergy Immunol 2004;133:317–29.10.1159/000077351Search in Google Scholar PubMed
35. Boumiza R, Debard AL, Monneret G. The basophil activation test by flow cytometry: recent developments in clinical studies, standardization and emerging perspectives. Clin Mol Allergy 2005;3:9.10.1186/1476-7961-3-9Search in Google Scholar PubMed PubMed Central
36. Glaumann S, Nopp A, Johansson SG, Rudengren M, Borres MP, Nilsson C. Basophil allergen threshold sensitivity, CD-sens, IgE-sensitization and DBPCFC in peanut-sensitized children. Allergy 2012;67:242–7.10.1111/j.1398-9995.2011.02754.xSearch in Google Scholar PubMed
37. Gernez Y, Tirouvanziam R, Yu G, Ghosn EE, Reshamwala N, Nguyen T, et al. Basophil CD203c levels are increased at baseline and can be used to monitor omalizumab treatment in subjects with nut allergy. Int Arch Allergy Immunol 2011;154:318–27.10.1159/000321824Search in Google Scholar PubMed PubMed Central
38. Ocmant A, Peignois Y, Mulier S, Hanssens L, Michils A, Schandene L. Flow cytometry for basophil activation markers: the measurement of CD203c up-regulation is as reliable as CD63 expression in the diagnosis of cat allergy. J Immunol Methods 2007;320:40–8.10.1016/j.jim.2006.12.002Search in Google Scholar PubMed
39. MacGlashan DW, Jr. Basophil activation testing. J Allergy Clin Immunol 2013;132:777–87.10.1016/j.jaci.2013.06.038Search in Google Scholar PubMed
©2015 by De Gruyter
This article is distributed under the terms of the Creative Commons Attribution Non-Commercial License, which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Articles in the same Issue
- Frontmatter
- Aktualisierte Anforderungen an die Messqualität und Qualitätssicherung (QS) von Point-of-Care-Testing (POCT)-Blutglukose-Messsystemen mit Unit-use Reagenzien, die für die Erstdiagnostik eines manifesten Diabetes in der Schwangerschaft oder eines Gestationsdiabetes mellitus (GDM) gemäß der GDM-Leitlinie der Deutschen Diabetes-Gesellschaft (DDG) geeignet sind
- Allergie und Autoimmunität/Allergy and Autoimmunity
- In-vitro Allergiediagnostik
- Pädiatrisches Labor/Pediatric Laboratory Medicine
- National and international initiatives and approaches for the establishment of reference intervals in pediatric laboratory medicine
- Klinische Chemie und Stoffwechsel/Clinical Chemistry and Metabolism
- Systematik der korrekten Laborabrechnung – rechtliche Rahmenbedingungen: Ergänzung und Aktualisierung zum Artikel in J Lab Med 2014;38(4):179–205
- Role of ischemia-modified albumin in clinical practice
- Original Article/Originalartikel
- Paraoxonase 2 Cys311Ser polymorphism and its association with the systolic blood pressure values in asymptomatic dyslipidemic individuals: a pilot study
- Kongressbericht/Congress Report
- 9. Deutsches BioSensor-Symposium, München 2015
Articles in the same Issue
- Frontmatter
- Aktualisierte Anforderungen an die Messqualität und Qualitätssicherung (QS) von Point-of-Care-Testing (POCT)-Blutglukose-Messsystemen mit Unit-use Reagenzien, die für die Erstdiagnostik eines manifesten Diabetes in der Schwangerschaft oder eines Gestationsdiabetes mellitus (GDM) gemäß der GDM-Leitlinie der Deutschen Diabetes-Gesellschaft (DDG) geeignet sind
- Allergie und Autoimmunität/Allergy and Autoimmunity
- In-vitro Allergiediagnostik
- Pädiatrisches Labor/Pediatric Laboratory Medicine
- National and international initiatives and approaches for the establishment of reference intervals in pediatric laboratory medicine
- Klinische Chemie und Stoffwechsel/Clinical Chemistry and Metabolism
- Systematik der korrekten Laborabrechnung – rechtliche Rahmenbedingungen: Ergänzung und Aktualisierung zum Artikel in J Lab Med 2014;38(4):179–205
- Role of ischemia-modified albumin in clinical practice
- Original Article/Originalartikel
- Paraoxonase 2 Cys311Ser polymorphism and its association with the systolic blood pressure values in asymptomatic dyslipidemic individuals: a pilot study
- Kongressbericht/Congress Report
- 9. Deutsches BioSensor-Symposium, München 2015

